微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 [???? ]
A.原电池反应均是自发的氧化还原反应
B.氢氧燃料电池工作时氢气在正极被氧化
C.氢氧燃料电池是将热能转变为电能的装置
D.铅蓄电池在放电过程中,负极质量减小,正极质量增加
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列有关电化学知识的描述正确的是 [???? ]
A.CaO+H2O== Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
参考答案:D
本题解析:
本题难度:一般
3、选择题 全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O

VO2++2H++V2+.下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.放电过程中,H+由正极移向负极
参考答案:A、原电池放电时,VO2+离子化合价降低,被还原,应是电源的
本题解析:
本题难度:一般
4、填空题 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
⑴I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)?+?5O2(g)=?2I2O5(s)?????△H=-75.56?kJ/mol?????????
2CO(g)?+?O2(g)=?2CO2(g)????△H=-566.0?kJ/mol????
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:________________。
⑵一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
a.体系压强保持不变??????????????????????
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变????????????
d.每消耗1?mol?SO2的同时生成1?molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________________。
⑶从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)??△H3
CH3OH(g)+H2O(g)??△H3
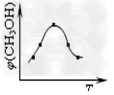
①取五份等体体积CO2和H2的的混合气体?(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)?与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3______0(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1?mol?CO2和3?mol?H2,进行上述反应。测得CO2和
CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5?mol?CO2和1.5?mol?
H2O(g)?(保持温度不变),则此平衡将______________移动(填“向正反应方向”、“不”或“逆反应方向”)
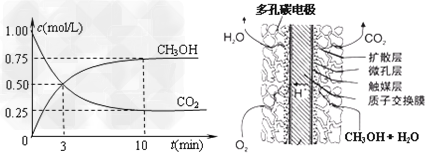
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为___________________________。
参考答案:⑴5CO(g)?+?I2O5(s)=5CO2(g)?+?I2
本题解析:
本题难度:一般
5、选择题 下列有关化学实验表现的内容错误的是( )
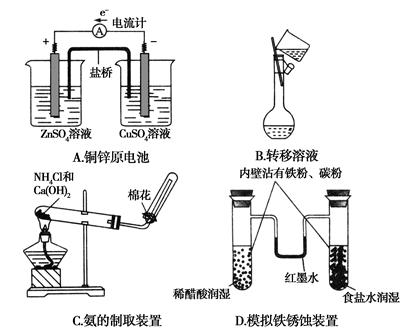
参考答案:A
本题解析:由A项两烧杯中的溶液可推知:盛放硫酸锌溶液的烧杯中的电极应为锌棒,盛放硫酸铜溶液的烧杯中的电极应为铜棒。由原电池原理判断:锌棒应为负极,铜棒应为正极,故A不正确。
本题难度:一般