微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室鉴别下列各组物质,所用的试剂不正确的是(???? )
A.NaHCO3和Na2CO3溶液,用Ba(OH)2溶液
B.矿物油和植物油,用NaOH溶液
C.乙酸和乙醇,用Na2CO3溶液
D.淀粉和肥皂水,用碘水
参考答案:A
本题解析:
试题分析:A.NaHCO3和Na2CO3溶液,用Ba(OH)2溶液均有白色沉淀产生,无法区别,故A不正确;?????
B.植物油是脂类,矿物油是烃,所以加NaOH溶液,煮沸植物油会发生水解,变得澄清,故B项正确;
C.乙酸和Na2CO3溶液反应产生气体,而乙醇与Na2CO3溶液不反应,故C项正确;?????????
D.碘遇淀粉变蓝,这一性质可用于检验淀粉,故D正确。故选A。
点评:本题考查物质的鉴别,难度不大,平时应注意积累常见的特性反应,用于检验特定的物质。
本题难度:简单
2、选择题 如果家里的食用花生油混有水份,下列方法可采用分离( )
A.过滤
B.蒸馏
C.分液
D.萃取
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.1molO的质量是16g/mol
B.Na+ 的摩尔质量是23g/mol
C.CO2的摩尔质量是44
D.氢的摩尔质量是2g/mol
参考答案:B
本题解析:试题分析:A.1molO的质量是16g或O的摩尔质量是16g/mol。错误。B.Na+的摩尔质量是23g/mol正确。C.CO2的摩尔质量是44g/mol。错误。D.氢的摩尔质量是2?g/mol?概念不明确。是指的氢原子还是氢分子。错误。
考点:考查摩尔、摩尔质量、质量等概念及适用范围的知识。
本题难度:一般
4、填空题 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:
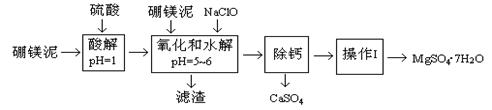
已知:NaClO与Mn2+反应产生MnO2沉淀。
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
|
开始沉淀pH
| 2.3
| 4.0
| 7.6
|
完全沉淀pH
| 4.1
| 5.2
| 9.6
?
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有????????????、??????????????。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有??????????、??????????。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:?????????????????????????。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
?????????????????????????????????????????????????????????????????????????????????????。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是????????。
A.KSCN溶液??? B.淀粉KI溶液???C.H2O2 ????D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃)
| 40
| 50
| 60
| 70
| MgSO4
| 30.9
| 33.4
| 35.6
| 36.9
| CaSO4
| 0.210
| 0.20 7
| 0.201
| 0.193
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤??????、????????????????????。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为????????????????????(相对分子质量:MgSO4·7H2O-246? MgO-40)。
参考答案:(1)烧杯、100mL容量瓶(2分) (2)MnO2,SiO
本题解析:
试题分析:(1)由于实验室没有80ml容量瓶,所以要配制1.00mol/L的硫酸80.0mL,则需要100ml容量瓶。所以若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯和100ml容量瓶。
(2)由于NaClO与Mn2+反应产生MnO2沉淀,又因为于二氧化锰和二氧化硅都不与稀硫酸反应,所以在滤渣中存在,因此滤纸中还有MnO2,SiO2。
(3)由于NaClO与Mn2+反应产生MnO2沉淀,在反应中氯元素的化合价从+1价降低到-1价,得到2个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,因此氧化剂与还原剂的物质的量之比是1:1,则NaClO与Mn2+反应产生MnO2沉淀的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;由于溶液中有亚铁离子,能够被次氯酸钠氧化成铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O。
(4)铁离子能和KSCN溶液反应使溶液显红色,所以可以向溶液中加入硫氰化钾溶液检验溶液中是否存在三价铁离子,方法为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+,A正确;由于溶液中含有次氯酸钠,能氧化碘化钾,所以不能使用碘化钾,B不正确;双氧水和酸性高锰酸钾溶液均具有强氧化性,不能检验铁离子,CD不正确,答案选A。
(5)由于温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,所以要将MgSO4和CaSO4混合溶液中的CaSO4除去可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;而操作“I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到了MgSO4?7H2O。
(6)100g硼镁泥中氧化镁的物质的量=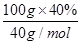 =1mol,根据镁原子守恒,生成MgSO4?7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,所以MgSO4?7H2O的产率= =1mol,根据镁原子守恒,生成MgSO4?7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,所以MgSO4?7H2O的产率=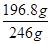 ×100%=80.0%。 ×100%=80.0%。
本题难度:一般
5、选择题 下列括号中的物质是除去杂质所需的药品,其中错误的是( )
A.NaCl中有杂质Na2SO4(氯化钡)
B.FeSO4中有杂质CuSO4(铁粉)
C.CO2中有少量CO(灼热的氧化铜)
D.CO2中有少量HCl气体(氢氧化钠溶液)
参考答案:D
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772