微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K)
| 平衡时NH3的物质的量(mol)
|
T1
| 2.4
|
T2
| 2.0
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(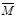 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
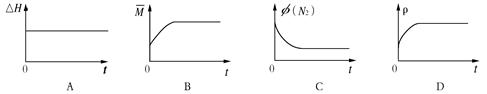
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
2、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
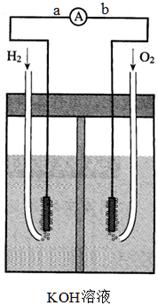
(1)氢氧燃料电池的能量转化主要形式是由???????转化为????????,在导线中电流方向为???????→??????(用a、b 表示)。
(2)正极反应式为?????????????????????,负极发生?????????反应(填“氧化”或“还原”)。
(3)氢氧燃料电池的能量转化率??????????????100%(填<、>、=)。
(4)电极表面镀铂粉的原因为????????????????????????????????。
3、实验题 (15分)高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。电解法制备高铁酸钾操作简便,成功率高,易于实验室制备。其原理如下图所示。
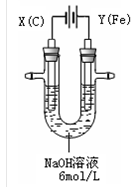
I. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(1)电解过程中,X极是 极,电极反应是 。
(2)电解过程中,Y极放电的有 。
(3)生成高铁酸根(FeO42-)的电极反应是 。
II. 若用不同种电池作为上述实验的电源,请分析电池反应。
(1)铅蓄电池总的化学方程式为:
2H2O+2PbSO4 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
。
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为 。
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是 ;
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是 。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
写出该电池正极的电极反应: 。
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是 。
4、选择题 汽车的启动电源常用铅蓄电池。下列叙述正确的是 [???? ]
A. 放电时,电子从PbO2一极流入铅板
B. 放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4
C. 充电时,PbO2得到电子,被氧化
D. 放电时,溶液的酸性增强
5、选择题 有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)( )
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6?L?O2,可向外提供2.4×104?C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O
D.放电一段时间后,溶液的pH升高
|