微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
4P(红,s)+5O2(g)===2P2O5(s) ΔH1
4P(白,s)+5O2(g)===2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是[???? ]
A.ΔH1=ΔH2
B.ΔH1>ΔH2
C.ΔH1<ΔH2
D.无法确定
2、简答题 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
(1)CH4可与Cl2反应,其反应机理如下:
(2)Cl2→2Cl2△H=+243kJ?mol-1
①Cl2→2Cl????△H=+243KJ??mol-1
②Cl+CH4→CH3+HCl???△H=+4KJ?mol-1
③CH3+Cl2→CH3Cl+Cl????△H=-106KJ?mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:
(2)在一定条件下,发生反应:CH4(g)+H2O(g)
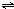
ClO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).若在2L密闭容器中发生反应,T℃时,通入2mol?CH4(g)和2mol?H2O(g),反应达平衡后,生成l?mol?CO,此时向容器中同时加入1mol?CO和3molH2的混合气体(保持温度不变),则平衡将______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g)
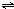
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有______.(选填序号).
a.再充入1mol?H2??b.使用健化剂??c.再充入2mol?CO??d.升高温度
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:
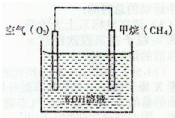
?????
?则正极的电极反应式为:______;
反应一段时间后溶液的pH______(填“升高”、“降低”或“不变”).
3、填空题 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)下列△H表示物质燃烧热的是______;表示物质中和热的是______(填“△H1”、“△H2”、“△H3”等).
A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)2.00g?C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式______.
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与100mL浓度为5mol?L-1的KOH溶液完全反应生成一种正盐.则燃烧1mol丁烷放出的热量为______.
4、填空题 将煤转化为水煤气的主要化学反应为:
C+H2O
高温
.
CO+H2
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
H2(g)+1
2
O2(g)═H2O(g)△H=-242.0kJ?mol-1
CO(g)+1
2
O2(g)═CO2(g)△H=-283.0kJ?mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:______.
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图(见图):
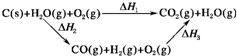
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是______(填“甲”或“乙”);判断的理由是______.
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______,
______.
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料.
CO和H2在一定条件下可以合成:①甲醇、②甲醛、③甲酸、④乙酸.
试分析当CO和H2按1:1的体积比混合反应,合成上述______(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.
5、选择题 S(单斜)和S(正交)是硫的两种同素异形体。已知:
① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) == S(正交,s) △H3下列说法正确的是[???? ]
A.△H3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)=== S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|