微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) + Q?? (Q > 0 )
NH2COONH4(s) + Q?? (Q > 0 )
(1)如用如图装置制取氨气,你所选择的试剂是??????????????????。

制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。
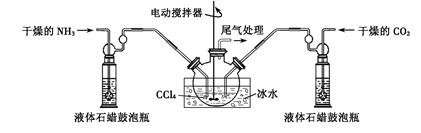
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是___________ __????_。
(3)液体石蜡鼓泡瓶的作用是_______。
(4)从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干??????? b. 高压加热烘干?????? c. 真空40 ℃以下烘干
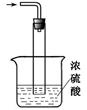
(5)尾气处理装置如图所示。双通玻璃管的作用:________??????;浓硫酸的作用:???????????????????????、______________????????_。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为
___________。(精确到2位小数)
参考答案:(1) 浓氨水与生石灰(氢氧化钠固体等) (2分,合理即给分
本题解析:
试题分析:(1)由于氨水中存在平衡关系NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。
NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。
(2)反应2NH3(g)+CO2(g) NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。
NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。
(3)因为气体参与反应的不易控制反应速率和用量,所以液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,即通过观察气泡,调节NH3与CO2通入比例。
(4)制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小,其晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,所以答案选c。
(5)氨气易溶于水,所以需要有防倒吸装置,双通玻璃管的作用是防止液体倒吸;氨气是碱性气体,浓硫酸是强酸,且具有吸水性,所以浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。该物质是碳酸钙,其物质的量为1.000g÷100g/mol=0.010mol。设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳原子守恒得到;x+y=0.01,又因为78x+79y=0.7820,解得x=0.008mol、y=0.002mol,则样品中氨基甲酸铵的物质的量分数= ×100%=80%。
×100%=80%。
本题难度:困难
2、选择题 下列物质与水混合后静置,不会出现分层的是( )
A.汽油
B.苯
C.四氯化碳
D.乙醇
参考答案:A.汽油和水互不相溶,与水混合后静置,出现分层,故A不选;<
本题解析:
本题难度:一般
3、选择题 下列与实验相关的叙述中,正确的是????????????????????
A.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘
B.从CuSO4溶液中结晶得到CuSO4?5H2O的操作是加热浓缩,冷却结晶并过滤
C.酸碱中和滴定时,加入待测液前锥形瓶中有水,测定结果偏低
D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+
参考答案:B
本题解析:乙醇和水互溶,不能作为萃取碘水中的碘,A不正确;酸碱中和滴定时,加入待测液前锥形瓶中有水,对实验结果是不影响的,C不正确;D不正确,因为无法排除原溶液中是否含有Fe3+,所以答案选B。
本题难度:简单
4、填空题 硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为????????,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为?????????????。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为???????????????。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是???????????????????????????。若用惰性电极电解MgCl2溶液,其阴极反应式为 ????????????????。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为??????????????????。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为???????。已知Ksp[Mg(OH)2]=5.6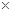 10-12,当溶液pH=6时???????(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时???????(填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将??? 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为???????滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 ??????。(提示:I2+2S2O32-=2I-+S4O62-)
参考答案:(1)+3(2分) B4O72-+2H++5H2O= 4H3
本题解析:
试题分析:(1)根据硼砂的化学式Na2B4O7?10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与2H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O= 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应,化学方程式为:Mg+B2O3===2B+3MgO。
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;用惰性电极电解MgCl2溶液,阴极反应为H2O电离出的H+放电,电解方程式为:2H2O+Mg2++2e-= H2↑+Mg(OH)2↓
(3)镁-H2O2酸性燃料电池的正极为H2O2放电,电极方程式为:H2O2+2H++2e-=2H2O;起始电解质溶液pH=1,pH=2时反应的H+为:0.1mol?L?1—0.01mol?L?1=0.09mol?L?1,根据Mg+H2O2+2H+==Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH?)=10-8mol?L?1,Q [Mg(OH)2]=" 0.045" mol·L-1×[10-8mol?L?1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出。
(4)Na2S2O3为强碱弱酸盐,水解显碱性,所以Na2S2O3溶液应盛放在碱式滴定管内;根据元素守恒和离子方程式可得:2B ~ 2BI3 ~ 3I2 ~ 6 S2O32-,所以粗硼样品的纯度为:0.018L×0.30mol?L?1×1/3×11g/mol÷×100% = 99%
本题难度:困难
5、选择题 能鉴别NH4Cl、K2SO4、NaCl、(NH4)2SO4四瓶无色溶液的试剂是
A.Ba(NO3)2溶液
B.Ba(OH)2溶液
C.AgNO3溶液
D.NaOH溶液[
参考答案:B
本题解析:能鉴别NH4Cl、K2SO4、NaCl、(NH4)2SO4四瓶无色溶液的试剂要求加入后会有四种不同的现象,正确选项为B;
当在NH4Cl溶液中加入Ba(OH)2溶液,会有刺激性气味气体生成;当在K2SO4溶液中加入Ba(OH)2溶液,会产生白色沉淀;当在NaCl溶液中加入Ba(OH)2溶液,无明显现象;当在、(NH4)2SO4溶液中加入Ba(OH)2溶液既有白色沉淀生成,又有刺激性气味气体生成;
本题难度:简单