微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值。高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料。
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解。
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许。
Ⅳ.调节pH至8~10, 加热至60~70℃, ,搅拌1h,过滤,除去残渣。
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为 x g/L。
请回答:
(1)用电子式表示HCl的形成过程?????。
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是?????(填序号)。
①原子半径?????????②最外层电子数
③金属性???????????④最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式:?????。
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理?????。
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式:?????。
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为?????。
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818g,溶剂为1000 g,经测定该溶液的密度为1.5 g/mL,则该溶液溶质的质量浓度x为??????g/L(计算结果保留整数)。
参考答案:(14分)
(1) 本题解析:略
本题解析:略
本题难度:一般
2、实验题 (8分)用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取???????mL浓硫酸?????????
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸倒入100 mL容量瓶中?????
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
⑴第步操作中应用量筒量取???????mL浓硫酸;应选择??????mL量筒(填5、10或50)
⑵本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器?是???????????、??????????、??????????????。(可以不填写满)
⑶正确的操作顺序是(用序号填写)????????????????????????????????????????????。
⑷定容时,如果俯视刻度线,配制的硫酸浓度将偏 ????????(填大或小)
参考答案:(8分)(1)5.4mL;? 10?(各1分)?????(2
本题解析:略
本题难度:一般
3、实验题 医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
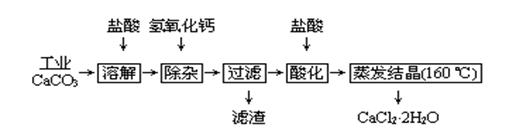
已知:查阅资料得知氢氧化物沉淀时的pH为:
氢氧化物
| Fe(OH)3
| Al(OH)3
|
开始沉淀时的pH
| 2.3
| 4.0
| 开始溶解:7.8
|
完全沉淀时的pH
| 3.7
| 5.2
| 完全溶解:10.8
?
(1)CaCO3与盐酸反应的离子方程式???????????????????????????????????????。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为?????????????????,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是?????????????????
????????????????????????????????????????????????????????????????。
(3)过滤时需用的玻璃仪器有??????????????。滤渣主要成分的化学式???????????。
(4)酸化时加盐酸的目的为:①??????????????????????????????????,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃:???????????????????????????????????????。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为?????????????????????????????????????。
参考答案:(16分,每空2分)
(1)CaCO3+2H+=Ca2
本题解析:
试题分析:(1)盐酸是强酸,酸性比碳酸强,则难溶于水的碳酸钙易溶于盐酸,生成可溶性的氯化钙、二氧化碳气体和水,将易溶且易电离的化合物改写成离子形式,其余物质都保留化学式,删去实际上未反应的离子,则该反应为CaCO3+2H+=Ca2++CO2↑+H2O;(2)根据表中氢氧化物完全沉淀时的pH可知,除去溶液中少量铁离子和铝离子应使溶液pH介于5.2~7.8之间或者5.2≤pH<7.8,低于3.7时铁离子不能完全变为氢氧化铁沉淀,低于5.2时铝离子不能完全变为氢氧化铝沉淀,高于7.8时,氢氧化铝开始变为偏铝酸根离子,溶液又引入新的杂质;检验氢氧化铁是否沉淀的方法就是检验溶液中是否存在铁离子,由于铁离子遇KSCN溶液变红的特征反应,通常设计的实验方案为:静置,取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,反之,则Fe(OH)3沉淀不完全;(3)过滤属于化学实验基本操作,也是混合物分离与提纯的常用方法,主要使用烧杯、玻璃棒、普通漏斗等仪器;当溶液pH介于5.2~7.8之间时,铁离子、铝离子完全变为氢氧化铁沉淀、氢氧化铝沉淀,则过滤所得滤渣的成分为Fe(OH)3、Al(OH)3;(4)氢氧化钙是除杂试剂,除杂试剂一定过量,氢氧化钙是强碱,由于目标产物是氯化钙,则酸化时加入盐酸的目的是除去过量的氢氧化钙,将其转化为氯化钙,防止氢氧化钙吸收空气中的二氧化碳,且过量的盐酸受热易挥发逸出(逸出的氯化氢气体可循环利用),不能加硝酸或硫酸酸化,因为它们除去旧杂质时会引入硝酸根离子或硫酸根离子等新杂质;(5)结晶水化合物受热可能失去结晶水,蒸发结晶要控制温度在160℃的原因是,温度太高,二水合氯化钙会失去结晶水;(6)滴定原理为:Ag++Cl-=AgCl↓,若氯离子的物质的量偏大,则测定结果偏高;酸化后所得溶液主要含有氯化钙、氯化钠、氯化氢,蒸发结晶时逸出氯化氢,但是没有除去钠离子,则所得晶体是二水合氯化钙和氯化钠的混合物,氯元素的质量分数:CaCl2>NaCl> CaCl2?H2O >CaCl2?2H2O,因此晶体样品中含有NaCl或二水合氯化钙失去全部或部分结晶水得到的CaCl2或CaCl2?H2O,都能导致所含氯元素的质量分数偏高,则所测样品二水合氯化钙的质量分数偏高。
本题难度:困难
4、选择题 下列实验操作中正确的是
A.制取溴苯:将铁屑、溴水、苯混合加热
B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
D.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色
参考答案:C
本题解析:
试题分析:A不正确,应该用液溴;B不正确,应该是先加入浓硝酸,再加入浓硫酸,最后加入苯;D不正确,加入硝酸银溶液之前,应该先加入硝酸酸化,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:简单
5、实验题 配制500mL 1.0mol·L—1的NaOH溶液时,下列哪些操作会使实验结果偏高_____________;偏低__________;无影响______________。
A.称量时,直接把氢氧化钠放在纸上称量,且称量时间过长
B.称量时,固体放在右盘,砝码放在左盘
C.称量时所用砝码生锈
D.原容量瓶用蒸馏水洗净后未干燥
E . 移液后,未洗涤烧杯和玻璃棒
F. 定容时,俯视刻度线
G. 颠倒摇匀溶液后,发现液面低于刻度线,再补加水到刻度线
H. 溶液尚未冷却到室温就注入容量瓶进行定容
参考答案:偏高(CFH)偏低(ABEG)无影响(D)
本题解析:略
本题难度:简单
|