微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氨基甲酸铵常用于生产医药试剂、发酵促进剂、电子元件等,是一种可贵的氨化剂。某学习小组研究在实验室中制备氨基甲酸铵的化学原理。
(1)将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强(kPa)
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度 (10-3mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
①上述反应的的焓变:?H 0,熵变?S 0(填“>”、“<”或“=”)
根据表中数据,计算出25.0℃时2NH3(g)+CO2(g)  NH2COONH4(s)的化学平衡常数K= 。 NH2COONH4(s)的化学平衡常数K= 。
③若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将 (填“增大”、“减小”或“不变”)。
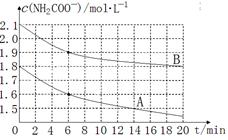
(2)氨基甲酸铵极易水解:NH2COONH4+2H2O  NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。 NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
2、选择题 某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
A.△H<0,△S>0
B.△H<0,△S<0
C.△H>0,△S>0
D.△H>0,△S<0
3、填空题 如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为???????????????????,反应在10分钟内的化学反应速率用Z来表示则V(Z)=??????????????。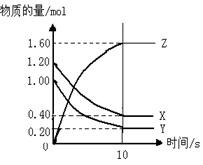
4、填空题 T1温度下,反应2SO2(g)+O2(g) 2SO3(g) △H<0的平衡常数K=532.4。 2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K= ,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)="0.0600" mol·L-1,c(O2)="0.400" mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为 。
(2)该反应△S 0,升高温度,平衡常数 (填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
容器
| 甲
| 乙
| 反应物投入量
| 2molSO2、1molO2
| 4molSO3
| 平衡时n(SO3)/mol
| 1
| m
| 反应物的转化率
| ?1
| ?2
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是 。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,?1+?2 1(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。
5、选择题 某反应吸热(ΔH>0),在常温下能自发进行,则该反应的ΔS
A.可能大于0
B.可能小于0
C.肯定大于0
D.肯定小于0
|
|