微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语正确的是:
A.8个中子的碳原子的核素符号:12C
B.H2O的电子式: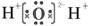
C.Cl-离子结构示意图: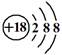
D.甲烷的结构式: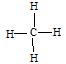
参考答案:D
本题解析:8个中子的碳原子的质量数是14,A不正确。水是共价化合物,电子式为 ,B不正确。氯离子的质子数是17,所以正确的答案是D。
,B不正确。氯离子的质子数是17,所以正确的答案是D。
本题难度:一般
2、选择题 氯酸质量分数超过40%时会发生分解,反应可表示为:8 HClO3 =" 3" O2↑+ 2 Cl2↑+ 4 HClO4 + 2 H2O,下列说法正确的是
A.氧化性比较HClO4 > HClO3
B.氧化产物只有HClO4
C.氯酸分解后的混合气体平均相对分子质量为47.6
D.该反应转移电子数为12e—
参考答案:C
本题解析:氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以选项A不正确;根据方程式可知,氯元素的化合价从+5价部分升高到+7价,部分降低到0价。而氧元素的化合价从-2价升高到0价,所以氧化产物有氧气和高氯酸,选项B不正确;根据氧气和氯气的体积之比是3︰2可知,混合气的平均相对分子质量是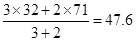 ,选项C正确;选项D不正确,转移电
,选项C正确;选项D不正确,转移电
本题难度:一般
3、选择题 氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
A.金属锈蚀
B.海水晒盐
C.食物腐败
D.燃放鞭炮
参考答案:B
本题解析:
试题分析:A、金属锈蚀发生电化学腐蚀,属于化学变化过程,涉及氧化还原反应,错误;B、海水晒盐不属于氧化还原反应,正确;C、食物的腐败是食物缓慢氧化变质的过程,属于氧化还原反应,错误;D、燃放鞭炮是剧烈的氧化还原反应过程,错误。
本题难度:简单
4、填空题 为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
水解反应
| 平衡常数(K)
|
Fe3+ + 3H2O  ?Fe(OH)3 + 3H+ ?Fe(OH)3 + 3H+
| 7.9 × 10-4
|
Fe2+ + 2H2O  ?Fe(OH)2 + 2H+ ?Fe(OH)2 + 2H+
| 3.2 × 10-10
|
Cu2+ + 2H2O  ?Cu(OH)2 + 2H+ ?Cu(OH)2 + 2H+
| 3.2 × 10-7
?
请回答:(1)稀硝酸和Cu反应的化学方程式为??????????????????????????????????。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方 案:??????????????????????????????????????????????????。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
实验内容
| 实验现象
| 甲同学的实验方案
| 溶液逐渐变成蓝绿色, pH略有上升
| 乙同学的实验方案
| 无明显现象,pH没有明显变化。
?
①据实验现象写出发生反应的离子方程式:????????????????????????????????。
②导致实验过程中溶液pH略有上升的可能原因是??????????????????????????。
③解释乙同学的实验现象??????????????????????????????????。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:????????????????????。
参考答案:(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2
本题解析:
试题分析:(1)稀硝酸和Cu反应的化学方程式为3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)乙同学认为Fe(NO3)3溶液具中的NO3-也能氧化Cu,据此设计对照实验,配制pH与Fe(NO3)3溶液相同但只含NO3-不能氧化CuNO3-不含Fe3+的溶液即可,将铜放入该溶液中,观察二者是否反应
(3)①根据丙同学的实验证明甲同学的结论是正确的,发生的离子反应方程式为Cu + 2Fe3+ = Cu2+ + 2Fe2+②根据水解反应的平衡常数知Fe3+水
本题难度:困难
5、填空题 工业上利用电解饱和食盐水可制得重要化工产品。
(1)写出化学方程式并标出电子转移的方向和数目:
(2)氧化剂:
还原剂:
(3)每转移1mol电子,可得到 mol氯气;
利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t。
参考答案:(1)
 本题解析: 本题解析:
试题分析:(1)电解饱和食盐水生成氢气、氯气和氢氧化钠,是氯碱工业的基础,反应中氯失去电子被氧化,氢得电子被还原;(2)化合价降低了的反应物为氧化剂,化合价升高了的反应物为还原剂;(3)每转移1mol电子,可得到0.5mol氯气;NaCl---HCl ,盐酸的物质的量为100t×36.5%÷36.5×58.5=58.5t 。
考点:电解饱和食盐水、氧化还原反应
本题难度:一般
|
|