绿色固体不溶于水
Ⅱ.探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②根据以上资料,白色物质化学式可能为 。
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒附着物,洗涤、干燥,连接下列装置进行实验,验证阴极产物。
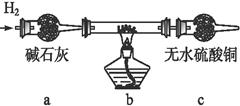
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质有无Cu2O? (填“有”或“无”),请简要说明的理由:
;
②在c装置后将气体通入硝酸银溶液中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在,写出装置b中发生反应的化学方程式: 。
(3) 由以上实验分析可知:电解CuCl2溶液的阴极上发生的电极反应式为Cu2++2e- Cu和 。 Cu和 。
参考答案:(10分)(1)CuCl (2分)<
本题解析:
试题分析:(1)根据表中提供的信息可知,只有CuCl是白色不溶于水的固体,所以白色物质的化学式可能是CuCl;
(2)①根据实验现象,无水硫酸铜未变蓝色,说明无水生成,则该红色物质中不含O元素,所以不含Cu2O;
②使硝酸银溶液产生白色沉淀的是氯离子,说明氢气与CuCl的反应中有氯离子生成,同时白色物质变为红色,说明有Cu单质生成,所以氢气与CuCl反应生成Cu和HCl,化学方程式为2CuCl+H2 2Cu+2HCl; 2Cu+2HCl;
(3)由以上分析可知,电解氯化铜溶液阴极上的产物是Cu和CuCl,除了Cu2++2e- Cu外还有Cu2++e-+Cl- Cu外还有Cu2++e-+Cl- CuCl↓发生。 CuCl↓发生。
考点:考查对实验现象的分析,电极反应式的书写
本题难度:困难
2、选择题 将1L含有2mol?CuSO4和1molNaCl的水溶液用惰性电极电解.电解一段时间后,一个电极上得到0.4mol?Cu,另一电极析出的气体( )
A.只有Cl2
B.只有O2
C.既有Cl2又有O2
D.只有H2
参考答案:溶液中含有n(Cu2+)=2mol,n(Cl-)=1mol;
本题解析:
本题难度:简单
3、填空题 (11分)右图所示为相互串联的甲、乙两电解池,试回答:
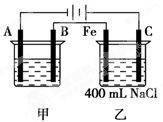
⑴若甲池利用电解原理在铁上镀银,则A电极材料是________,电极反应式是________________,B是_______极,应选用的电解质溶液是________?????;
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____??色,
C极附近呈_______色;
⑶若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________mL;
⑷若乙池中剩余溶液仍为400 mL,则电解后所得NaOH溶液的物质的量浓度为________mol/L,pH等于
________。
参考答案:(1)铁;Ag++e-=Ag;阳;AgNO3?(2)红;无?
本题解析:
试题分析:(1)电镀是待镀金属做阴极,和电源和负极相连。镀层金属做阳极,和电源的正极相连,含有镀层金属离子的溶液做电镀液。若甲池利用电解原理在铁上镀银,则A电极材料是铁,溶液中的银离子在负极得到电子,电极反应式是Ag++e-=Ag。B是阳极,应选用的电解质溶液是硝酸银溶液。
(2)乙池中铁电极和电源的负极相连,做阴极,溶液中的氢离子放电,所以铁电极负极水的电离平衡被破坏,溶液显碱性,即溶液呈红色。碳棒和电源的正极相连,做阳极,溶液中的离子放电生成氯气,所以碳棒附近溶液呈无色。
(3)甲
本题难度:一般
4、选择题 在下图装置中,若通电一段时间后乙装置左侧电极质量增加,下列说法错误的是
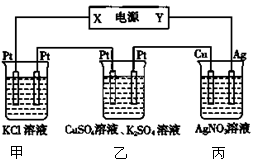
A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g
B.电解过程中装置丙的pH无变化
C.丙中硝酸银溶液的浓度不变
D.乙中左侧电极反应式:Cu2++2e-=Cu
参考答案:A
本题解析:
试题分析:由装置甲发生的反应可得两电极产生的气体体积相等,所以产生氢气为2.24 L,转移电子0.2 mol,则铜电极上生成Ag0.2 mol,质量为21.6 g,A错误。装置内阴极析出银单质,阳极上的银失去电子变成银离子,理论上溶液的物质的量浓度不变,pH保持不变,B正确。装置甲中开始的反应为:2KCl+2H2O2KOH+H2↑+Cl2↑,故要使溶液恢复可通入适最HCl气体即可,C正确。乙装置的左侧电极质量增加,则左侧为阴极,由此可确定X极为负极,Y为正极,乙装置中铜离子放电,D正确。答案选A。
考点:电解池原理
本题难度:一般
5、选择题 如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
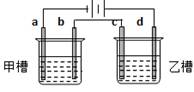
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组
| A
| B
| C
| D
| 甲槽
| NaOH
| Cu(N O3)2
| KCl
| Na2SO4
| 乙槽
| CuSO4
| NaCl
| AgNO3
| NaNO3
参考答案:C
本题解析:观察四选项可知,依据电解反应及离子的放电顺序:满足甲槽中电解液pH上升的只有AC选项符合,排除BD;而AC选项中乙槽电解液pH均下降符合题意。
A选项中的b电极反应式分别为:4OH--4e-=2H2O+O2↑?? c电极反应:Cu2++2e-=Cu
C选项中的b电极反应式分别为:2Cl--2e-=Cl2↑?? c电极反应:Ag++e-=Ag
依题目要求,在等量的电子通过的情况下,b、c两极放电离子的物质的量相等,排除A项
故答案为C
本题难度:简单
|
|