微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表给出几种物质的熔点,对此有下列一些说法:???????????????????????
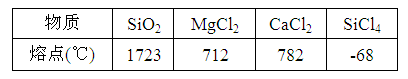
①CaCl2属于离子晶体??????????????????????????②SiCl4是分子晶体
③一个SiO2分子由1个Si原子和2个O原子构成? ④SiO2在熔融状态下能导电
上述说法中正确的有(???)?????????????????????????????????????????????????
A.仅①
B.仅②
C.①和②
D.①、②和③
参考答案:C
本题解析:氯化钙是有活泼的金属和活泼的非金属形成,所以是离子化合物,形成离子晶体,根据其熔点也能判断出。SiCl4的熔点很低,形成的晶体应该是分子晶体。二氧化硅的熔点很高,形成的晶体应该是原子晶体,在原子晶体中不存在分子。原子晶体在熔融状态下是不导电的,所以答案是C。
本题难度:一般
2、选择题 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
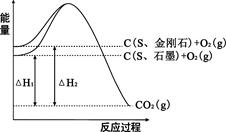
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
参考答案:B
本题解析:
试题分析:A、物质的能量越低越稳定,根据图中曲线可知,石墨的能量低于金刚石,所以石墨比金刚石稳定,错误;B、石墨转化为金刚石吸热,所以?H=395.0kJ?mol?1-393.5kJ?mol?1=+1.5kJ?mol?1,正确;C、根据图中曲线可知△H1的绝对值<来源:91考试网 91exam.org;△H2的绝对值,因为燃烧为放热反应,?H<0,所以△H1>△H2,错误;D、使用催化剂不影响?H,错误。
本题难度:一般
3、填空题 (14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
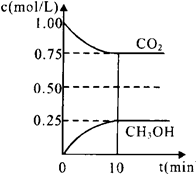
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使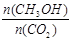 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
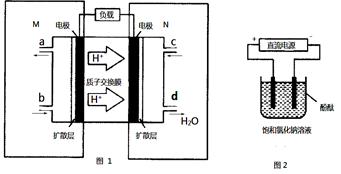
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
参考答案:(1)①AB
本题解析:
试题解析:(1)①未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;②升高温度,平衡逆向移动,故比值减小,故A错误;恒温恒容下充入He(g),平衡不移动,故比值不变,故B错误;将H2O(g)从体系中分离,平衡正向移动,故比值变大,故C正确;恒温恒容再充入2mol CO2和3mol H2,相当于增大压强,平衡正向移动,故比值变大,故D正确;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以: K=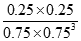 =0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O
=0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O
H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O H2↑+Cl2↑+2OH-可知:
H2↑+Cl2↑+2OH-可知:
CH3OH ~ 6e- ~ 6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g;
(3)应用盖斯定律解题,△H=-△H1-△H2+ △H3+2△H4=-(
△H3+2△H4=-( c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-(
O2(g)=CO2(g)+2H2O(l)△H=-( c+2d-a-b)kJ?mol-1。
c+2d-a-b)kJ?mol-1。
考点:化学反应中的能量变化、化学平衡、电化学
本题难度:一般
4、填空题 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:
参考答案:
本题解析:
本题难度:一般
5、选择题 在带有活塞的密闭容器中发生反应: Fe2O3+3H2==2Fe+3H2O,采取下列措施不能改变反应速率的是
A.增加Fe2O3的量
B.保持容器体积不变,增加H2输入量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器内体积不变
参考答案:AD
本题解析:试题分析:A项增加固体的量不能加快反应速率;D项充入N2,保持容器内体积不变,则各气态反应物、产物浓度不变,因此化学反应速率不发生改变。而B项增加H2相当增加反应物的浓度。C项充入N2,保持容器内压强不变,则各气态反应物、产物浓度改变,因此化学反应速率改变,故选AD。
考点:影响化学反应速率的因素
点评:压强只对气体参与或生成的反应才有影响,同时,充入不参与反应的气体,要注意是保持体积不变还是压强不变,从而确定浓度是否变化,才能更好的解决这种类型题。
本题难度:简单