微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
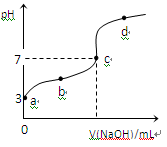
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中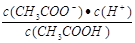 相等
相等
参考答案:C
本题解析:
答案C
恰好完全反应时,产物为CH3COONa,是强碱弱酸盐,水解后溶液呈碱性,pH>7
本题难度:一般
2、填空题 (12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量浓度
(mol·L-1)
| NaOH物质的量浓度
(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| C1
| 0.2
| pH=7
|
丙
| 0.1
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸??????????????????????????????????????????????????????????。
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1???????(填“是”或“否”)。混合溶液中c(A-)与 c(Na+)离子浓度的大小关系是??????(填序号)。A.前者大??? B.后者大??? C.一样大???? D.无法判断 c(Na+)离子浓度的大小关系是??????(填序号)。A.前者大??? B.后者大??? C.一样大???? D.无法判断
(3)从丙组结果分析,HA是????????酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是????????????????????????????????????????????????????????。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=????????mol·L-1。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
3、填空题 现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知:CO2+3H2O+2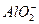 ====2Al(OH)3↓+ ====2Al(OH)3↓+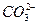 。 。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号)。
(2)当上述物质的量浓度均为0.1mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是________(填编号)。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为______________。
参考答案:(1)④>②>①>③>⑤(2)⑤
本题解析:(1)在题给五种电解质中,NaOH是强碱,可完全电离,前四种都是弱酸强碱盐,在溶液中可水解,根据盐类的水解规律,谁弱谁水解,越弱越水解,可得知同物质的量浓度的四种盐水解后,其碱性即pH:③>①>②>④。因此当五种溶液的pH相同时,其物质的量浓度:④>②>①>③>⑤。
(2)因为NaOH完全电离,稀释10n倍,pH就减少n;其余四种均是盐溶液,稀释可以促进盐的水解,稀释10n倍,pH的减少小于n。所以pH变化最大的是⑤。
(3)AlCl3是强酸弱碱盐,也
本题难度:简单
4、填空题 (5分)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L?? b.CH3COOH+NaHCO3=CH3COONa +CO2↑+H2O +CO2↑+H2O
则CH3COONH4溶液呈?????????性(填“酸”、“碱”或“中”),NH4HCO3溶液呈????性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是???????(填离子的化学式)。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
5、选择题
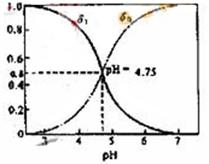
分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与PH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO-),则c= c(CH3COOH)+c(CH3COO-),设CH3COOH所占分配系数为δ1,CH3COO-所占分配系数为δ0,它们与PH的关系如图所示。下列有关说法正确的是(? )
A.由曲线可知在PH为1~7时,一定有δ1+δ0=1
B.c mol/L 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性
C.向CH3COOH溶 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0
D.在 cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c
参考答案:A
本题解析::A项可直接依图判断是正确的;CH3COOH与CH3COONa等量混合后,应考虑以CH3COOH的电离为主,溶液显酸性,故B项错误;C项由离子关系可知,溶液显酸性,结合图示分析,在pH<7时,可能有δ1>δ0,δ1=δ0,δ1<δ0三种情况,故C也错;H2C2O4是一种弱酸,溶液中有三种型体浓度c(H2C2O4)、 c(HC2O4-)和c(C2O42-),故D也错。
本题难度:简单
|