微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 利用下图所示联合装置制备金属钛,下列叙述正确的是

A.甲装置中通入O2的电极反应式为:O2+4 e-= 2O2-
B.若不考虑能量的损失,制备24.0g金属钛,需要消耗氢气22.4 L
C.甲装置工作过程中pH减小
D.乙装置中的石墨电极反应式为:C+2O2--4e-=CO2↑
参考答案:D
本题解析:
试题分析:A、根据图中得知:电解质是磷酸,氧气产生的O2-跟H+结合生成H2O,电极反应式:O2+4e-+4H+=2H2O,错误;B、题目中不知道条件是不是标准状况,不能应用22.4mol/L,错误;C、甲装置反生的总电极反应式:2H2+O2=2H2O,对磷酸稀释,pH增大,错误;D、乙装置中的石墨,连接甲装置的正极,因此石墨做阳极,根据图乙装置C+2O2--4e-=CO2↑,正确。
考点:考查原电池和电解池的原理。
本题难度:困难
2、填空题 如图为相互串联的甲乙两电解池
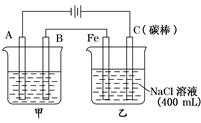
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A是 极,材料是 ,
电极反应为 。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重12.8g,则:乙池中阳极放出的气体在标准状况下的体积为
;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
参考答案:1)阴极;纯铜;Cu2++2 e- =" Cu" ;(2)红
本题解析:
试题分析:结合装置图,与电源负极相连的是阴极,与电源正极相连的是阳极,甲池若为用电解原理精炼铜的装置,则A是阴极,材料为纯铜,发生电极反应是Cu2++2 e- = Cu。
乙池中实质是电解NaCl饱和溶液,C极上放出Cl2,Fe极上生成H2 ,2H2O+2e-=H2↑+2OH,若滴入少量酚酞试液,电解一段时间后Fe极附近呈红色。若甲池为电解精炼铜,阴极增重12.8g,即转移的电子有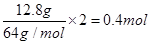 ,则乙池中阳极放出的气体在标准状况下的体积为
,则乙池中阳极放出的气体在标准状况下的体积为
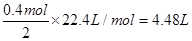 ;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为
;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为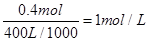 。
。
考点:电解池
点评:考查电解池实验装置图,难度不大,解题的关键是要区分正负极,电极发生的反应,把握得失电子情况,仔细计算。
本题难度:一般
3、填空题 (15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
参考答案:(1)1 2 1 1 2 2 2 (2分)ClO2(1分)(
本题解析:
试题分析:(1)根据在氧化还原反应中电子守恒、原子守恒可得该方程式是:H2C2O4 +2NaClO3 +H2SO4 →Na2SO4+ 2CO2↑ + 2ClO2↑ + 2H2O。在该反应中氧化剂是NaClO3,所以变成的还原产物是ClO2。(2)根据方程式可知:每产生2mol的ClO2,会反应消耗1mol的草酸,所以若该反应产生0.2 mol ClO2,需要消耗草酸晶体0.1mol,其质量是0.1mol ×126g/mol="12.6g." (3)在上述反应物中属于第三周期的元素有Na、S、Cl,同一周期的元素,元素序数越大,原子半径就越小,所以原子半径大小顺序是Na>S>Cl;(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与HClO、Na2O2、H2O2相同。(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,该反应的离子方程式是:2ClO2+2CN-→2CO2+N2+2Cl-;(6)NaCl是离子化合物,其中的化学键是离子键;在工业上用电解熔融的氯化钠制备金属钠,根据同种电荷相互排斥,异种电荷相互吸引的原则,氯气是阴离子Cl-在阳极失去电子产生。
考点:考查氧 化还原反应方程式的配平、方程式的书写、化合物的化学键类型的判断及有关计算的知识。
本题难度:一般
4、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用。电解质溶液为KOH溶液,电池反应为:
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是[???? ]
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是[???? ]
A.放电时电池内部OH-向正极移动
B.放电时正极附近溶液的pH减少
C.充电时阳极反应为 Cd(OH)2+2e-=Cd+2OH-
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
参考答案:D
本题解析:
本题难度:一般
5、选择题 电解饱和食盐水,不能直接得到的物质是( )
A.氢气
B.氯气
C.氢氧化钠
D.氯化氢
参考答案:惰性电极电解氯化钠溶液,阳极电极反应为:2Cl--2e-=C
本题解析:
本题难度:简单