微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 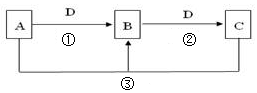
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是???????????,工业上制取A的离子方程式Ⅰ为?????????????????。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 ????????????????????。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是?????。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式?????????;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
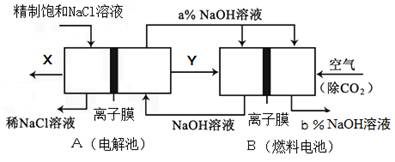
(6)Ⅰ①图中X、Y分别是????????????(填化学式),分析比较图示中氢氧化钠质量分数a%????????b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应????????????。
参考答案:(1)FeCl3???? 2Cl-+2H2O![]()
本题解析:(1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2,工业上制取A的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,反应①的化
本题难度:一般
2、选择题 下列说法正确的是( )
A.漂白粉的有效成分是氯化钙和次氯酸钙
B.欲除去氯气中少量的氯化氢气体,可将此混合气体通过盛饱和氢氧化钠溶液的洗气瓶
C.将氯水滴入碳酸钠溶液中,无明显现象出现
D.向久置的氯水中滴入紫色石蕊试液,溶液将变红
参考答案:D
本题解析:
试题分析:漂白粉的主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,A不正确;B不正确,因为氯气也能和氢氧化钠溶液反应,应该用饱和食盐水;氯气中含有盐酸,能和碳酸钠溶液反应,C不正确;次氯酸不稳定,易分解生成氯化氢和氧气,则氯水久置后将变为稀盐酸,滴入紫色石蕊试液,溶液将变红色,D正确,答案选D。
点评:该题紧扣教材,基础性强,侧重对学生基础知识的检验和训练,难度不大。该题的关键是熟练记住氯水的主要成分以及性质特点,然后结合题意灵活运用即可。
本题难度:一般
3、填空题 氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是_________;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2—放电产生气体的电极反应式______________。(2)利用化学反应也能制取氟。请配平下列化学方程式:
____K2MnF6+____SbF5—____KSbF6+____MnF3+____F2↑;其中还原产物是________。
(3)某温度下测得浓度均为0.10mol/L的KF和HF混合液的pH=4,近似计算HF的电离平衡常数Ka(写出计算过程)。
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随PH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:_____________________________。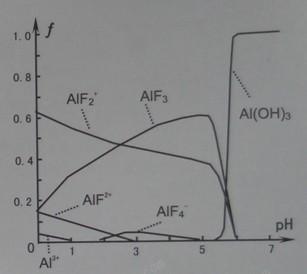
参考答案:(1)氟化氢是共价化合物,纯液态时不电离,因而不导电;
本题解析:略
本题难度:一般
4、填空题 浓硫酸在高中化学实验中有着很重要的作用
(1)①铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色固体。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。则黑色固体中含有________元素。
②实验室利用浓硫酸分别与氯化钠固体和碘化钾固体加热反应制取所需物质,分析这两个反应中浓硫酸作用的异同点:_________________________________ 。
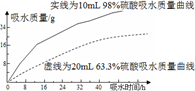
(2)探究浓硫酸的吸水性。某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图。由右图曲线你能得到的实验结论有哪些?(写两点)______、_______________。
(3)苯与浓硝酸、浓硫酸制硝基苯的实验中,三种原料混合的顺序是_____________;要得到纯净的硝基苯,需经过:水洗 → 5%NaOH溶液洗涤 → 水洗 → 无水CaCl2干燥→________(填写操作),得到纯硝基苯。
(4)探究浓硫酸在生成乙酸乙酯反应中的作用。
问题提出:浓硫酸存在条件下酯化反应是否进行得更快。
设计实验:____________________。实验现象:___________________ 。
(5)浓硫酸与蔗糖反应的演示实验装置修改如下:实验时在大试管中先放入2g细小颗粒的蔗糖,滴加2—3滴碳酸钠浓溶液,再加入1.5mL 98%的浓硫酸,迅速塞紧带干燥管的单孔橡皮塞。可以看到,蔗糖迅速变黑,体积急剧膨胀,形成多孔海绵状固体物质——“黑面包”。分析实验效果更加明显的原因:____________________________________________________ 。
(6)苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________、__________________。(至少写出两点)
用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)________m3(保留2位小数)。
参考答案:
(1)Cu、S;相同点均为难挥发性的酸,不同点后者还
本题解析:
试题分析:
(1)①向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,证明溶液中含有Cu元素;向所得溶液加BaCl2溶液后有白色沉淀生成。证明溶液中含有SO42-,则又黑色固体中含有S元素。因此该固体中含有Cu、S量元素。
②浓硫酸与两种物质发生的反应为2NaCl+H2SO4(浓)  Na
Na
本题难度:一般
5、填空题 (3分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。
漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式
______________________________________________________________
(2)漂白粉的有效成分是__________________________(填化学式)。
参考答案:(3分)(1)? 2Cl2 +2Ca(OH)2=CaCl2+
本题解析:略
本题难度:一般