微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列溶液中的离子浓度关系正确的是
A.pH =3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol?L-1
B.Na2S溶液中:c(Na+)>c(HS-)>c(OH-)>c(H2S)
C.pH =2的盐酸与pH =12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
参考答案:D
本题解析:
试题分析:醋酸是弱酸,部分电离,根据电荷守恒,溶液中c(H+)=c(CH3COO-)+c(OH-),A项错误;硫化钠是强电解质,电离出Na+和S2-,硫离子水解生成HS-,则溶液中离子浓度的大小关系为c(Na+)>c(OH-)>c(HS-)>c(H2S),B项错误;氨水是弱碱,pH =2的盐酸与pH =12的氨水等体积混合,溶液为氯化铵和氨水,溶液显碱性,C项错误;根据越弱越水解,酸性强弱的顺序为CH3COOH>H2CO3 >HClO,NaClO的水解能力最强,其次为NaHCO3,水解能力最弱的是CH3COONa ,则pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,D项正确;选D。
考点:考查离子浓度的大小关系。
本题难度:困难
2、选择题 下列有关化学用语表达正确的是
A.碳酸氢根离子的水解方程式:HCO3-+H2O H3O++CO32-
H3O++CO32-
B.聚丙烯的结构简式: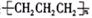
C.钾原子的结构示意图:
D.甲烷分子的比例模型:
参考答案:D
本题解析:
试题分析:A、 碳酸氢根离子的水解方程式应为HCO3-+H2O H2CO3+OH-;B、聚丙烯的结构简式为
H2CO3+OH-;B、聚丙烯的结构简式为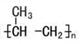 ,错误;C、钾原子的结构示意图为
,错误;C、钾原子的结构示意图为 ,错误;D、甲烷的比例模型为
,错误;D、甲烷的比例模型为 ,正确;故本题选择D。
,正确;故本题选择D。
考点:化学用语的描述
本题难度:一般
3、填空题 研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)
参考答案:
本题解析:
本题难度:困难
4、填空题 (12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 。稀释后还需要加入一些铁粉,其目的是 ,相关反应的离子方程式为 。
(2)氯化铁水溶液呈 性,原因是(用离子方程式表示):___________ ____ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
参考答案:(12分)(1)抑(防)止Fe2+水解(2分);
本题解析:(1)Fe2+离子会发生水解,离子方程式为: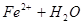 ?
?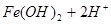 ,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成
,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成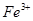 ,所以加入铁粉是为了防止Fe2+被氧化成Fe3+:
,所以加入铁粉是为了防止Fe2+被氧化成Fe3+: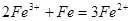 ;
;
(2)氯化铁水溶液呈酸性,原因是:Fe3+ + 3H2O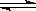 Fe(OH)3 + 3H+;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是:Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干;
Fe(OH)3 + 3H+;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是:Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干;
本题难度:简单
5、选择题 25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号
| ①
| ②
| ③
| ④
|
溶液
| NaCl
| CH3COONH4
| NaF
| NaHCO3
|
pH
| 7.0
| 7.0
| 8.1
| 8.4
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)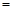 0.1 mol/L 0.1 mol/L
参考答案:B
本题解析:
试题分析:A.酸越弱,其酸根离子水解程度就越大,溶液的碱性就越强。由于0.1mol0.1mol/L NaF溶液的pH=8.1,NaHCO3溶液的pH=8.4,所以酸性HF> H2CO3,正确;B.NaCl是强酸强碱盐,盐电离产生的离子不能发生水解反应,所以对水的电离平衡不产生影响,CH3COONH4是弱酸弱碱盐,盐电离产生的阳离子和阴离子都发生水解反应,消耗水电离产生的H+、OH-,促进水的电离,使水的电离程度增大,所以由水电离产生的c(H+):①<②,错误;C.NaCl是强酸强碱盐,不发生水解,根据电荷守恒可得c(Na+)+c(H+)=c(Cl-)+c(OH-),而NaF是强碱弱酸盐,F-发生水解反应消耗,所以c(Cl-)>c(F-),F-发生水解反应消耗水电离产生的H+,使溶液显碱性,所以c(H+)前者大于后者,因此离子总浓度:前者大于后者,①>③,正确;D.④溶液中,根据物料守恒可得:c(HCO3-)+c(CO32-)+c(H2CO3)=" 0.1" mol/L,正确。
考点:考查盐水解平衡常数的应用、盐溶液对水电离平衡的影响、溶液中离子定向比较的知识。
本题难度:一般
|