微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。



 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:


 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式??????????????????。
(1)写出装置A中发生反应的离子方程式??????????????????。
 (2)装置A中g管的作用是??????????????;装置C中的试剂是?????????;装置E中的h瓶需要冷却理由是?????????????????。
(2)装置A中g管的作用是??????????????;装置C中的试剂是?????????;装置E中的h瓶需要冷却理由是?????????????????。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是?????????????(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是?????????????(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:


 ①滴定前是否要滴加指示剂????????????(填“是”或“否”),请说明理由??????????。
①滴定前是否要滴加指示剂????????????(填“是”或“否”),请说明理由??????????。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是???????????。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是???????????。
参考答案:(1)MnO2 + 4H+ + 2Cl- 本题解析:略
本题解析:略
本题难度:一般
2、实验题 (12分)某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:
A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2—3滴酚酞指示剂。
B.用待测的NaOH溶液润洗碱式滴定管。
C.把滴定管用蒸镏水洗净。
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻
度“0”以上2cm—3cm处,把酸式滴定管固定好,调节液面。
E.检查滴定管是否漏水,并分别固定在滴定管架两边。
F.另取锥形瓶,再重复滴定操作一次。
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直
至终点,记下滴定管的液面所在刻度。
据上述滴定操作,完成下列填空:
⑴滴定操作的正确操作顺序是(用上述各编号字母填写)
???????→E→??????→B→??????→??????→??????;
⑵ G步操作中判断滴定终点的依据是????????????????????????????????????????;
⑶ D步骤的操作中液面应调节到????????????????,尖嘴部分应????????????????;
⑷酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会??????????;
碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会?????????。
(填“偏高”、“偏低”或“无影响”。)
参考答案:(12分)(1)(2分)C、D、A、G、F
(2)(2
本题解析:略
本题难度:一般
3、选择题 下列装置不能达到实验目的是(???)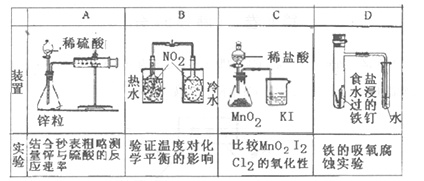
参考答案:C
本题解析:A项可根据相同时间内收集的气体体积多少来测量反应速率,正确;B项根据两瓶气体的颜色来验证温度对平衡的影响,正确;C项应该用浓盐酸与二氧化锰在加热条件下反应,错;D项根据试管中的导管是否形成水柱来判断,正确。
本题难度:简单
4、实验题 某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯:已知有关物质的沸点如下表:
物质
| 甲醇
| 苯甲酸
| 苯甲酸甲酯
|
沸点/℃
| 64.7
| 249
| 199.6
实验装置如下:

(1)简述第一步混合液体时,最后加入浓硫酸的理由是
???????????????????????????????????????????????????????????????。
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:
??????????????????????????????????????????????????????。
(2)分液时上层液体从?????????????????????出来;接受馏分时温度控制在??????。
(3)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点:?????????????????、??????????????????????。
II、苯甲酸甲酯碱性水解
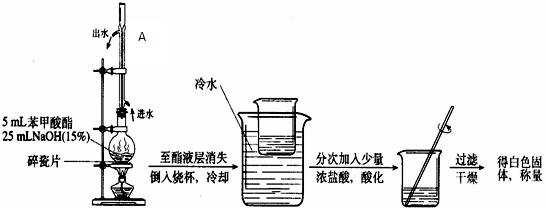
(4)写出苯甲酸甲酯碱性水解的化学反应方程式?????????????????????????。
(5)写出苯甲酸甲酯碱性水解实验装置中A的作用??????????????????????。
III、苯甲酸甲酯有多种同分异构体
(6)符合下列条件的结构
①可以发生银镜反应②属于芳香族化合物③不具备其它环状结构④不能与FeCl3发生显色反应;共有??????种。
参考答案:(16分)(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量
本题解析:I(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,为确保实验的安全所以采用最后加入浓硫酸,再加上甲醇的沸点低易挥发;
酯化反应的特点是:酸脱羟基醇脱氢,所以其反应机理为:
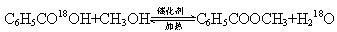
(2)分液时,上层液体应从分流漏斗的上口倒出,下层液体应从分流漏斗的下口倒出。
根据苯甲酸甲酯的沸点可知,接受馏分时温度控制在199.6℃左右
(3)这样操作可以使反应物尽可能多的转化为生成物,使反应物得到充分反应,且生成的产物更纯。
II:(4)酯的水解反应是酯化反应的逆反应,且酯在碱性条件下水解较彻底
C6H5COOCH3 + NaOH? →?C6H5COONa + CH3OH
(5)该装置中冷管的作用为冷凝回流
III(6)共12种,如下图所示
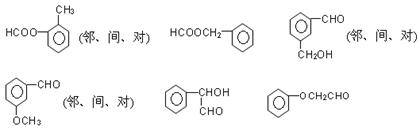
能发生银镜反应的物质有:醛类、甲酸、甲酸某酯、甲酸盐、还原性糖等。
本题难度:简单
5、实验题 (14分)把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
A.将配好的稀硫酸倒入试剂瓶中,贴好标签;
B.盖好容量瓶塞,反复颠倒,摇匀;
C.用量筒量取ml的18.0mol·L-1的浓硫酸;
D.将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中;
E.用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入???????mL的容量瓶中;
G.改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线????????cm处。
请回答:
(1)填写上述步骤中的空白:C ??????, F??????????,? H??????????????。
(2)请按正确的操作步骤进行排序???????????????????????????????????。
(3)试分析下列操作会使所配溶液的浓度是大于还是小于、等于2.00 mol·L-1浓度?
①若在操作中没有将硫酸溶液冷却至室温,就转移到容量瓶中,之后进行定容,最终会使稀硫酸溶液的浓度 (大于,小于,等于) ????????2.00 mol·L-1。
②若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度(大于,小于,等于)????????????2.00 mol·L-1。
③若摇匀后发现液面低于刻度线,又加水至刻度线,会使稀硫酸溶液的浓度(大于,小于,等于)?????????2.00 mol·L-1。
参考答案:(15分)(1)? 11.1ml???? 100?????
本题解析:略
本题难度:一般
|