微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用稀H2SO4溶液与Na2CO3溶液反应来制取二氧化碳,欲制得最多的二氧化碳,则下列叙述正确的是
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把Na2CO3溶液滴加到H2SO4溶液中
D.把H2SO4溶液滴加到Na2CO3溶液中
参考答案:C
本题解析:分析:根据反应的离子方程式H++CO32-=HCO3-、H++HCO3-=CO2↑+H2O进行判断.
解答:如硫酸过量,无论怎样混合,生成的CO2的物质的量相同,
如硫酸不足时,把Na2CO3溶液滴加到H2SO4溶液中,发生:2H++CO32-=CO2↑+H2O,Na2CO3全部生成CO2;
把H2SO4溶液滴加到Na2CO3溶液中,发生:H++CO32-=HCO3-; H++HCO3-=CO2↑+H2O,溶液中存在HCO3-,生成的CO2较少;
故选C.
点评:本题考查碳酸钠与硫酸的反应,题目难度中等,本题注意滴加的顺序不同,发生的反应不同.
本题难度:简单
2、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.由非金属性Cl>S,可推知酸性HClO3>H2SO4
C.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ Cl2↑+ HClO4 + H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
参考答案:B
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,即HClO4>H2SO4,B不正确,其余都是正确的,答案选B。
本题难度:困难
3、选择题 通常情况下溶液中发生的氧化还原反应速率要比复分解反应速率慢,向一定量的Fe、Fe2O3的混合物中,加入足量盐酸,要保证有气体产生,则该混合物中Fe和Fe2O3的物质的量比至少应
A.大于1:1
B.等于1:1
C.小于1:1
D.大于2:1
参考答案:A
本题解析:分析:由题意可知,首先发生反应Fe2O3+6HCl=2FeCl3+3H2O,铁离子氧化性强于氢离子,再发生反应Fe+2Fe3+=3Fe2+,由于有气体生成,故最后发生反应Fe+2HCl=FeCl2+H2↑,说明Fe与Fe3+时Fe有剩余,令化合物中Fe2O3为1mol,据此计算Fe的物质的量取值进行解答.
解答:由题意可知,首先发生反应Fe2O3+6HCl=2FeCl3+3H2O,铁离子氧化性强于氢离子,再发生反应Fe+2Fe3+=3Fe2+,由于有气体生成,故最后发生反应Fe+2HCl=FeCl2+H2↑,说明Fe与Fe3+时Fe有剩余,
令化合物中Fe2O3为1mol,生反应Fe2O3+6HCl=2FeCl3+3H2O后,溶液中n(Fe3+)=2mol,发生反应Fe+2Fe3+=3Fe2+后Fe有剩余,故n(Fe)>1mol,所以混合物中Fe和Fe2O3的物质的量比至少大于1:1,
故选A.
点评:本题考查混合物的有关计算、根据方程式的计算,难度中等,根据题目信息判断发生反应的先后顺序是解题的关键.
本题难度:简单
4、选择题 把11.5 g金属钠投入到过量的m1 g水中得到a溶液,把12 g镁投入到过量的m2 g盐酸中得到b溶液,若m1=m2,则a、b的质量关系为
A.ma>mb
B.maC.ma=mb
D.无法确定
参考答案:C
本题解析:ma=m1 g+11.5 g-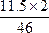 ?g
?g
=(m1+11) g
mb=m2 g+12g- g=(m1+11) g
g=(m1+11) g
故ma=mb。
本题难度:困难
5、选择题 跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是
A.H2O
B.CO2
C.Ca(OH)2
D.H2SO4
参考答案:D
本题解析:A错,NaOH、Na2CO3、NaHCO3与水不反应;B错,Na、NaHCO3与CO2不反应;C错,Na、Na2O、Na2O2、NaOH与Ca(OH)2???????不反应;D正确;
本题难度:一般