微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为[???? ]
A.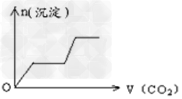
B.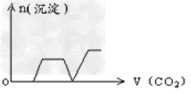
C.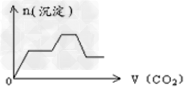
D.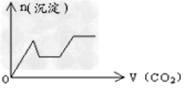
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列电离方程式中,正确的是
A.NH3?H2O═NH4++OH-
B.H2S?H++S2-
C.CH2COOH+NH3?H2O?CH3COO-+NH4++H2O
D.H2O?H++OH-
参考答案:D
本题解析:分析:A、氨水是弱电解质,不能使用等号;
B、氯化氢是弱电解质,电离方程式要分步写;
C、不是电离方程式,是化学反应方程式;
D、水是弱电解质,电离方程式使用可逆号.
解答:A、由于氨水属于弱电解质,电离方程式使用可逆号,正确离子方程式是:NH3?H2O?NH4++OH-,故A错误;
B、氯化氢属于二元弱酸,电离方程式需要分步写,离子方程式:H2S?H++HS-,HS-?H++S2-,正确故B错误;
C、是醋酸和氨水反应的化学方程式,不是电离方程式,故C错误;
D、水是弱电解质,电离方程式用可逆号,离子方程式是:H2O?H++OH-,书写正确,故D正确;
故选D.
点评:本题考查电离方程式的书写,注重了基础知识的考查,难度较低.
本题难度:简单
3、选择题 下列各组离子中,因发生氧化还原反应而不能大量共存的是
A.Fe3+、H+、SO、ClO-
B.Fe3+、Fe2+、SO、OH-
C.Al3+、Na+、SO、HCO3-
D.K+、H+、I-、MnO
参考答案:D
本题解析:分析:具有氧化性的离子与具有还原性的离子发生氧化还原反应,则不能大量共存,以此来解答.
解答:A.因H+、ClO-结合生成弱电解质,则不能共存,故A不选;
B.因Fe3+、Fe2+分别与OH-结合沉淀,则不能共存,故B不选;
C.因Al3+、HCO3-相互促进水解生成沉淀和气体,则不能共存,故C不选;
D.因H+、I-、MnO4-发生氧化还原反应,则不能共存,故D选;
故选D.
点评:本题考查离子的共存,明确习题中的信息及常见离子之间的反应是解答本题的关键,注意不能共存的原因,题目难度不大.
本题难度:困难
4、选择题 一些化合物在相同温度下的溶解能力:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,FeS>CuS,不正确的是
A.Zn2++S2-+2H2O→Zn(OH)2↓+H2S↑
B.Mg2++2HCO32-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O
C.Cu2++FeS→CuS+Fe2+
D.Cu2++H2S→CuS+2H+
参考答案:A
本题解析:分析:根据物质的溶解能力可知,沉淀转化时向溶解能力更小的方向移动,且不溶于的物质在离子反应中保留化学式,以此来解答.
解答:A.由Zn(OH)2>ZnS可知,则ZnS不会与H2O反应生成Zn(OH)2,故A错误;
B.由溶解性MgCO3>Mg(OH)2可知,发生Mg2++2HCO32-+2Ca2++4OH-→Mg(OH)2↓来源:91考试网 91ExaM.org+2CaCO3↓+2H2O,故B正确;
C.由FeS>CuS可知,能发生沉淀转化为Cu2++FeS→CuS+Fe2+,故C正确;
D.CuS为难溶电解质,则能发生Cu2++H2S→CuS+2H+,故D正确;
故选A.
点评:本题考查沉淀的转化及离子反应,明确物质溶解能力的大小是解答本题的关键,注意沉淀转化的方向即可解答,题目难度中等.
本题难度:一般
5、选择题 把0.05molBa(OH)2固体分别加入到下列100mL液体中,溶液导电性变化不大.该液体是( )
A.自来水
B.1.0mol/L盐酸
C.0.5mol/L硫酸
D.1.0mol/L氨水
参考答案:A.水中离子浓度较小,加入少量的氢氧化钡固体后,离子浓度增大
本题解析:
本题难度:简单