微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将SO2通入BaCl2溶液至饱和未见沉淀生成,继续通入某种气体仍无沉淀生成,则该气体可能是(??? )
A.CO2
B.NH3
C.Cl2
D.H2S
2、填空题 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理??????????????????????????????????????????。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是?????(填序号)
A.Ba(NO3)2
B.BaCl2
C.Ba(OH)2
D.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为??????????????????????????。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
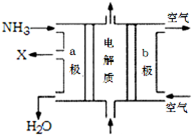
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作???????极(填“正”“负”“阴”或“阳”),其电极反应式为???????;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为??????????,请判断T??????25℃(填“>”“<”“=”)。
3、选择题 FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2易分解。实验室用稀硫酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是
A.H2S
B.S
C.FeS
D.FeSO4
4、填空题 近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:????????????????????????????????????。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:??????????????????????????????。
③写出步骤(Ⅲ)反应的离子方程式:?????????????????????????????????????。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42-的转化率。
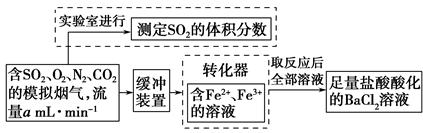
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是???????。(填写序号)

A.碘的淀粉溶液
B.酸性高锰酸钾溶液
C.氢氧化钠溶液
D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO 的转化率,已知气体流速,还需测定的数据有??????????????????、??????????????????????????。
的转化率,已知气体流速,还需测定的数据有??????????????????、??????????????????????????。
5、填空题 研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有??????????。(填写字母编号)
A.温室效应
B.酸雨
C.粉尘污染
D.水体富营养化
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为?????????????。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为????????????????。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
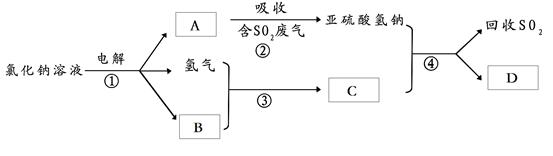 ???工业生产中,步骤③的反应条件为????????????????。
???工业生产中,步骤③的反应条件为????????????????。
该工艺中物质D可以作为原料循环利用,它的化学式为???????????????。
写出步骤②反应的离子方程式?????????????????????????????????????。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式???????????????????????。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_???????????????????????????????????。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应 ?
NO + NO2 + Na2CO3 = 2NaNO2 + CO2???????
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2?????
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为????????????????。