微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)现有A、B、C、D、E五种短周期元素,其原子序数依次增大。A、C的基态原子电子排布中未成对电子数与其周期数相等,且A的最外层电子数是次外层电子数的2倍。D的阳离子、C的阴离子均与氖原子的电子层结构相同,且D的单质与C的单质反应能生成D2C和D2C2两种化合物。E所在周期序数比所在主族序数大l。
(1)2011年是国际化学年,其中一项重要活动是纪念居里夫人获诺贝尔化学奖100周年。居里夫妇发现了放射I生镭(Ra)和钋(Po)元素,其中E与镭同主族,镭位于???????????族。
(2)E的基态原子的核外电子排布式是?????????,A、B、C三种元素中第一电离能最大的是????????????,B、c、D的原子半径由小到大的顺序为?????????????(均用元素符号?表示)。
(3)D2C2与AC2反应的化学方程式为?????????????,请写出该反应的一种用????????。
(4)B与氢元素形成最简单的气态氢化物的空间构型为????????????,其中共价键类型为??????????????(填极性键或非极性键)。已知B≡B键能为946 kJ·mol-1,H-H键能为
436 kJ·mol-1,B—H键能为391 kJ·mol-1,则B2和H2反应的热化学方程式为?????????。
参考答案:(1)IIA(2分)(2)1s22s22p63s2(2分)
本题解析:A的最外层电子数是次外层电子数的2倍表明A为碳,D的阳离子、C的阴离子均与氖原子的电子层结构相同,表明C、D分别属于第二、三周期,且C的基态原子电子排布中未成对电子数与其周期数相等,说明C为氧,则B为N,根据D的单质与C的单质反应能生成D2C和D2C2两种化合物知D为钠,E原子序数D大且为短周期,则E在第三周期,IIA为镁(E所在周期序数比所在主族序数大l),碳、N、氧的第一电离能最大的是N(N原子的2p轨道处于半充满,为稳定结构),根据同周期原子半径由左向右越来越小,同主族原子半径由上到下越来越大,B、
本题难度:一般
2、选择题 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物Al2H6的球棍模型如下图所示,它的熔点为150℃,燃烧热极高。下列说法肯定错误的是
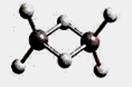
A.Al2H6在固态时所形成的晶体是分子晶体
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物可能成为未来的储氢材料和火箭燃料
D.氢铝化合物中可能存在组成为的物质(n为正整数)
参考答案:D
本题解析:
试题分析:A、氢铝化合物由分子构成,且熔点低,故为分子晶体,正确;B、正确;C、该物质燃烧热极高,故可能成为未来的储氢材料和火箭燃料,正确;D、该类化合物符合(AlH3)n,只有n=2时符合AlnH2n+2,错误。
本题难度:一般
3、填空题 用电子式表示下列物质的结构:
(1)CaCl2_______________________________________________。
(2)NH4Cl_____________________________。
(3)Ba(OH)2___________________________________________。
(4)Na2O2_____________________________。
(5)Na2S______________________________。
(6)MgO______________________________。
参考答案: 本题解析:①阴离子全用括号;②阴、阳离子均应标明电荷;③对称排列。
本题解析:①阴离子全用括号;②阴、阳离子均应标明电荷;③对称排列。
本题难度:简单
4、填空题 (艺高完成普高不做,12分)原子序数为12的元素,在周期表中位于______周期第______族;该元素为______(金属元素或非金属元素),在化学反应中容易______(失或得)电子;原子序数为17的元素,元素符号为______,该原子的电子式为______.
参考答案:原子序数为12的元素为Mg元素,原子核外有3个电子层,最外层
本题解析:
本题难度:一般
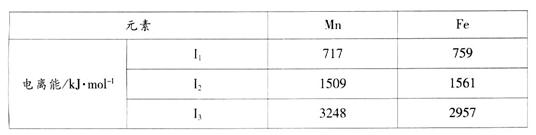
5、填空题 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为???????????????????????,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是???????????????。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是????????????。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是???????????,写出一种与 CN-互为等电子体的单质分子的电子式??????????????????????????。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为????????????????。
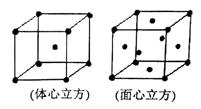
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为?????????????。
参考答案:(1)3d54s2(1分) 由Mn2+转化为Mn3+时,3d
本题解析:
试题分析:(1)Mn元素为2号元素,价电子的排布式为:3d54s2;Mn2+的价电子为3d5,3d轨道半充满,较稳定,由较稳定的3d5半充满态转为不稳定的3d4状态需要的能量较多;Fe2+的价电子为3d6,不稳定,由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
(2)①Fe原子或离子外围有较多能量相近的空轨道,所以与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子。
②CN-中C与N形成碳氮三键,所以C原子杂化方式为sp;原子数相等、价电子数相等的微粒
本题难度:一般