微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 给出下列条件,无法确定该物质摩尔质量的是(?)
A.已知液体物质的质量和物质的量
B.已知固体物质的体积和质量
C.已知气体在标准状况时的密度
D.已知物质一个分子的实际质量
参考答案:B
本题解析:略
本题难度:简单
2、计算题 某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
?
| 甲
| 乙
| 丙
|
烧杯+稀硫酸
| 200 g
| 150 g
| 150 g
|
加入的铁样品
| 9 g
| 9 g
| 14 g
|
充分反应后,烧杯+剩余物
| 208.7 g
| 158.7 g
| 163.7 g
请你认真分析数据,完成下列问题:
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应?
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所得溶液中溶质的质量分数。
(烧杯的质量为25.4 g;计算结果精确到1%)
参考答案:(1)乙? (2)93.3%? (3)17.1%
本题解析:(1)甲、乙、丙均产生0.3 g H2,甲可看作是在乙的基础上再加50 g H2SO4,丙可看作是在乙的基础上再加5 g铁,均未再多产生气体,说明乙中H2SO4与铁恰好完全反应。
(2)由乙组数据计算:
Fe+H2SO4====FeSO4+H2↑
56????????????????? 2
m(Fe)????????????? 0.3 g
m(Fe)= 本题难度:简单 本题难度:简单
3、填空题 0. 92 g铜和镁的合金完全溶于100 mL 63%浓硝酸(ρ=1.40 g/cm3)中,若反应中硝酸被还原只产生
896mL NO2和N2O4混合气体(都已折算到标准状况),在反应后的溶液中,加入足量的1.0 mol/L氢氧化钠溶液,生成1.77 g沉淀。
(1)63%浓硝酸(ρ=1.40 g/cm3)的物质的量浓度为____mol/L。
(2)产生的896 mLNO2和N2O4混合气体(都已折算到标准状况)中NO2的体积分数为___________。
(3)如果要使溶液中的金属离子恰好完全沉淀,需要加入1.0 mol/L氢氢化钠溶液的体积为_______ mL。
参考答案:(1)14.?0
(2)0. 75(或75%)
本题解析:
本题难度:一般
4、选择题 将50g浓度为18.4mol/L、密度为1.84g/cm3的某硫酸稀释成9.2mol/L的溶液.则加入水的体积(水的密度为1.0g/cm3)
A.小于50ml
B.等于50ml
C.大于50ml
D.等于ml
参考答案:A
本题解析:分析:令浓硫酸的体积为VmL,根据稀释定律计算稀释后溶液的体积,硫酸溶液的浓度越大密度越大,据此判断稀释后溶液的质量,进而判断加入水的质量,再根据V=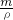 判断. 判断.
解答:令浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设稀释后溶液的体积为a,
则:VmL×18.4mol/L=a×9.2mol/L,解得a=2VmL,
硫酸溶液的浓度越大密度越大,所以稀释后硫酸的密度小于1.84g/cm3,故稀释后硫酸的质量小于100g,所以加入水的质量小于100g-50g=50g,
故加入水的体积小于 =50mL, =50mL,
故选A.
点评:本题考查物质的量浓度的有关计算,难度中等,清楚硫酸溶液的浓度越大密度越大是解题关键.
本题难度:简单
5、选择题 在a?L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b?mol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c?mol NH3,则原溶液中的Al3+的浓度(mol?L-1)为( )
A. b-2c
2a
B.2b-c
a
C.2b-c
3a
D.c-2b
6a
参考答案:由混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-
本题解析:
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|