微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学-选修2 化学与技术】
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
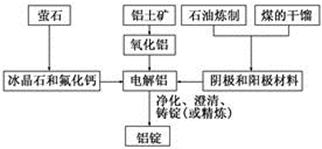
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能 x100%)
参考答案:(1)Al2O3;碳素材料;(2)降低Al2O3的熔点,减少
本题解析:
试题分析:(1)铝土矿的成分是Al2O3、Fe2O3、SiO2,主要成分是Al2O3;电解时的阴阳级材料是能导电的,一般是金属和石墨,而石油炼制和煤的干馏中不含金属,因此石油炼制和煤的干馏产品是碳素材料作电解铝的阴极好阳极材料;(2)金属铝冶炼是电解熔融状态下氧化铝,因为氧化铝的熔点非常高,消耗大量的电能,因此加入冰晶石和氟化钙可以降低氧化铝的熔点,减少电能的消耗;(3)冰晶石Na3[AlF6],氧化铝和冰晶石生成Al2OF62-和F-,根据反应前后原子个数守恒,Al2OF62-系数为3,则AlF63-系数4,化学反应方程式:Al2O3+4AlF63-===3Al2OF62-+6F-;电解时阳极是失电子,化合价升高,根据总反应C的化合价由0→+4,C参与了正极反应,冰晶石在整个电解过程中降低氧化铝的熔点,反应前后质量不变,阳极电极反应:C+2 Al2OF62-+12F--4e-===CO2↑+4 AlF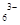 ;(4)(4)冰晶石Na3[AlF6]与足量NaOH溶液反应生成两种钠盐,根据元素守恒和原子个数守恒,Na作阳离子,Al作为阴离子AlO2-,F作为阴离子F-,反应的化学反应方程式:
;(4)(4)冰晶石Na3[AlF6]与足量NaOH溶液反应生成两种钠盐,根据元素守恒和原子个数守恒,Na作阳离子,Al作为阴离子AlO2-,F作为阴离子F-,反应的化学反应方程式: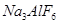 +4NaOH===6NaF+NaAlO2+2H2O;(5)9gAl的物质的量=
+4NaOH===6NaF+NaAlO2+2H2O;(5)9gAl的物质的量=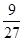 mol=
mol= mol,生产
mol,生产 mol铝消耗的电能为
mol铝消耗的电能为 ×1.8×106=6×105J,则热回收效率η=
×1.8×106=6×105J,则热回收效率η=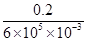 ×100%=0.033%。
×100%=0.033%。
考点:考查化学反应方程式的书写、材料的成分、化学计算等相关知识。
本题难度:困难
2、选择题 电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
参考答案:B
本题解析:
试题分析:在混合溶液中含有的阳离子是Cu2+、Na+、H+,放电能力最强的是Cu2+;含有的阴离子是Cl-、OH-,放电能力最强的是Cl-。所以在阳极发生反应:Cl-—2e-=Cl2↑,产生氯气;在阴极发生反应:Cu2+2e-=Cu,析出Cu。因此选项是B。
考点:考查电解原理的应用的知识。
本题难度:一般
3、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为 。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
参考答案:(1)阳极反应2Fe-4e-=2Fe2+,提供还原剂Fe2+
本题解析:明确本题的电解原理:用铁作阳极,产生的亚铁离子将Cr2O72-还原为Cr3+,再转化为氢氧化铬沉淀。
本题难度:一般
4、选择题 用惰性电极电解200mL一定浓度的CuSO4溶液,一段时间后,停止通电.为使溶液恢复到电解前的状态需向溶液中加入9.8gCu(OH)2.则电解后溶液中c(H+)约为( )
A.0.5mol/L
B.1mol/L
C.2mol/L
D.4mol/L
参考答案:9.8gCu(OH)2的物质的量=
本题解析:
本题难度:简单
5、选择题 将含有0.400 molCu(NO3)2和0.400 mol KCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上能析出0.300 mol铜,此时在另一电极上放出的气体在标准状况下的体积约为
A.3.36L
B.大于5.6L小于6.72L
C.6.72L
D.大于3.36L小于5.6L
参考答案:D
本题解析:气体析出顺序为先Cl2后O2,生成1 mol Cl2转移2 mol电子,生成1 mol O2转移4 mol电子,生成1 mol铜转移2 mol电子,总转移应守恒故

nO2="0.05" mol,总气体量0.25 mol,5.6L,故选D。
本题难度:一般