微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是(??)
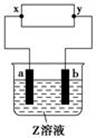
?
| a极板
| b极板
| x电极
| Z溶液
|
A
| 锌
| 石墨
| 负极
| CuSO4
|
B
| 石墨
| 石墨
| 负极
| NaOH
|
C
| 银
| 铁
| 正极
| AgNO3
|
D
| 铜
| 石墨
| 负极
| CuCl2
?
参考答案:A
本题解析:用活泼电极或惰性电极电解相同的溶液时现象可能不同。通电后a极板增重,表明溶液中金属阳离子在a极板上放电,发生还原反应析出了金属单质,因此可确定a极板是电解池的阴极,与它相连接的直流电源的x极是负极。故C不正确。A中电解液为CuSO4溶液,阴极a板上析出Cu而增重,阳极b板上由于OH-放电而放出无色无臭的O2,故A正确。B中电解液为NaOH溶液,通电后阴极a上应放出H2,a极板不会增重,故B不正确。D中电解液为CuCl2溶液,阴极a板上因析出Cu而增重,但阳极b板上因Cl-放电,放出黄绿色有刺激性气味的Cl
本题难度:一般
2、选择题 如图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是
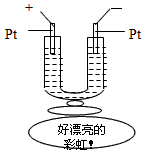 [???? ] [???? ]
A.蓝、紫、红
B.红、蓝、紫
C.红、紫、蓝
D.紫、红、蓝
参考答案:C
本题解析:
本题难度:一般
3、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
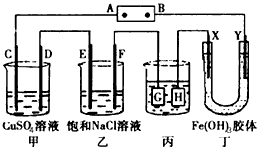 [???? ] [???? ]
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中看到的现象是X极附近红褐色变深
参考答案:B
本题解析:
本题难度:一般
4、填空题 (18分)X、Y、Z、W、E五种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
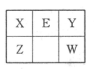
(1)能证明X、Z两元素非金属性强弱的离子方程式为
(2)一定条件下,在恒容容器中,充人一定量的WY2 (g)和XY (g),发生反应:
 时,各物质的平衡浓度如下表: 时,各物质的平衡浓度如下表:

①若温度升高到 T2℃时,反应的平衡常数为6.64,则该反应的逆反应为______反应(填“吸热”或“放热”)。
②其他条件不变,若该反应在恒压条件下进行,平衡时XY的转化率a2______a1(T1℃时的转化率)(填“<”“>”“=”)
(3)室温下,Mg(OH)2饱和溶液______(填“能”或“不能”)使石蕊试液变蓝,通过计算说明原因(已知: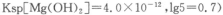 。答 。答
(4)化学反应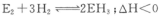 在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是______(填字母代号) 在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是______(填字母代号)
a.升高温度 b.加催化剂 c.增加H2的浓度 d.分离出EH3
一定条件下,1mol E2与3molH2在密闭容器中反应达到平衡,E2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为____________________.
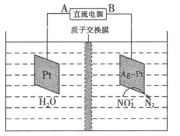
(5)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示。其中B为电源的______极,其电极反应式为_ _____。
参考答案:(1)CO2 +H2O +SiO32- ="===" H2S
本题解析:
试题分析:根据题意推断,X为碳元素,Y为氧元素,Z为硅元素,W为硫元素,E为氮元素。(1)元素的非金属性越强,最高价氧化物水化物的酸性越强,能证明碳酸的酸性强于硅酸,则证明碳的非金属性比硅强,离子方程式为CO2 +H2O +SiO32- ="===" H2SiO3↓+ CO32-;(2)一定条件下,在恒容容器中,充入一定量的SO2 (g)和CO (g),发生反应:SO2 (g)+2CO (g) 2CO2 (g)+S(l)。T1℃时,将各物质的平衡浓度代入平衡常数表达式计算平衡常数为40/9。①若温度升高到 T2℃时,反应的平衡常数为6.64,平衡常数增大,平衡正向移动,则该反应的逆反应为放热反应。②反应:SO2 (g)+2CO (g) 2CO2 (g)+S(l)。T1℃时,将各物质的平衡浓度代入平衡常数表达式计算平衡常数为40/9。①若温度升高到 T2℃时,反应的平衡常数为6.64,平衡常数增大,平衡正向移动,则该反应的逆反应为放热反应。②反应:SO2 (g)+2CO (g) 2CO2 (g)+S(l)正反应为气体物质的量减小的反应,其他条件不变,若该反应在恒压条件下进行,容器的体积减小,平衡正向移动,CO的转化率增大,即CO的转化率a2>a1;(3)根据氢氧化镁的溶度积常数计算, 2CO2 (g)+S(l)正反应为气体物质的量减小的反应,其他条件不变,若该反应在恒压条件下进行,容器的体积减小,平衡正向移动,CO的转化率增大,即CO的转化率a2>a1;(3)根据氢氧化镁的溶度积常数计算,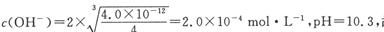 石蕊的变色范围为5——8,故氢氧化镁饱和溶液能使石蕊试液变蓝;(4)a.N2+3H2 石蕊的变色范围为5——8,故氢氧化镁饱和溶液能使石蕊试液变蓝;(4)a.N2+3H2 2NH3;△H<0,升高温度,平衡逆向移动,N2的转化率降低,错误;b.加催化剂平衡不移动,N2的转化率不变,错误;c.增加H2的浓度,平衡正向移动,N2的转化率升高,正确;d.分离出NH3平衡正向移动,N2的转化率升高,正确,选cd;一定条件下,1mol N2与3molH2在密闭容器中反应达到平衡,N2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为N2(g)+3H2(g) 2NH3;△H<0,升高温度,平衡逆向移动,N2的转化率降低,错误;b.加催化剂平衡不移动,N2的转化率不变,错误;c.增加H2的浓度,平衡正向移动,N2的转化率升高,正确;d.分离出NH3平衡正向移动,N2的转化率升高,正确,选cd;一定条件下,1mol N2与3molH2在密闭容器中反应达到平衡,N2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为N2(g)+3H2(g) 2NH3(g);△H=—92.4Kj/mol;(5)由题给装置图知右侧Ag—Pt电极上NO3—转化为N2,氮元素的化合价降低发生还原反应,右侧Ag—Pt电极为电解池的阴极,与直流电源的负极相连,故B为电源的负极,其电极反应式为2NO3- + 12H++ 10e- = N2↑ + 6H2O。 2NH3(g);△H=—92.4Kj/mol;(5)由题给装置图知右侧Ag—Pt电极上NO3—转化为N2,氮元素的化合价降低发生还原反应,右侧Ag—Pt电极为电解池的阴极,与直流电源的负极相连,故B为电源的负极,其电极反应式为2NO3- + 12H++ 10e- = N2↑ + 6H2O。
考点:考查元素周期表的结构与元素推断,离子方程式的书写,化学平衡,沉淀溶解平衡及化学反应与能量转化。
本题难度:困难
5、选择题 用惰性电极电解下列足量溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是???????????????????????????????????????????????????????????????????????? [???? ]
A.NaCl?[盐酸溶液] ??????????????
B.NaOH?[NaOH]????
C.AgNO3?[Ag2O] ??????????????????
D.CuSO4?[Cu(OH)2]
参考答案:C
本题解析:
本题难度:简单
|