微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,属于氧化还原反应的是 (?? )
A.CO2 + H2O = H2CO3
B.H2CO3 = CO2↑ + H2O
C.2H2O = O2 ↑ + 2 H2↑
D.CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
参考答案:C
本题解析:
试题分析:根据氧化还原反应特征元素化合价发生了变化,分析化合价就可判断C项正确。其他选项中各元素的化合价都没有发生变化。
点评:能根据化合价的变化判断是否是氧化还原反应
本题难度:一般
2、选择题 下列各项中表达正确的是
A.质量数为37的氯原子: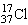
B.镁的原子结构示意图: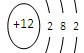
C.溴化银的化学式: AgBr2
D.NaOH在水中的电离方程式:NaOH= Na+ +O2—+H+
参考答案:B
本题解析:质量数为37的氯原子为37 17Cl;溴化银的化学式:AgBr;NaOH在水中的电离方程式:
NaOH= Na+ +OH—,选B。
本题难度:一般
3、选择题 布尔津县夏天蚊子特别多,被蚊子叮咬后人会感觉痛痒,这是由于蚊子分泌出的酸性物质有刺激作用,该酸性物质的主要成分是甲酸(CH2O2)。下列有关说法正确的是(???? )
A.甲酸溶液能使紫色石蕊试液变蓝色
B.甲酸中碳、氢、氧三种元素的质量比为6:1:16
C.甲酸由1个碳原子、2个氢原子和2氧原子构成
D.可选用浓氢氧化钠溶液等碱性物质来涂抹患处
参考答案:B
本题解析:
试题分析:甲酸属于酸类,能使紫色石蕊事业变红,甲酸是由甲酸分子构成的,如果用浓氢氧化钠溶液涂抹患处的话,会烧伤皮肤,因此正确的选项是B。
点评:该题属于初中化学知识。
本题难度:一般
4、选择题 下列有关化学用语的表述正确的是
A.质子数与中子数相等的氢原子符号: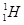
B.蔗糖和麦芽糖的分子式:C 12H22O11
C.乙烯的结构简式:CH2CH2
D.35Cl-、37Cl-的结构示意图: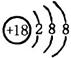
参考答案:B
本题解析:
试题分析:A、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以质子数与中子数相等的氢原子符号: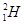 ,A不正确;B、蔗糖和麦芽糖均是二糖,互为同分异构体,分子式均是C12H22O11,B正确;C、乙烯的结构简式为CH2=CH2,C不正确;D、35Cl-、37C
,A不正确;B、蔗糖和麦芽糖均是二糖,互为同分异构体,分子式均是C12H22O11,B正确;C、乙烯的结构简式为CH2=CH2,C不正确;D、35Cl-、37C
本题难度:一般
5、填空题 (14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。

将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。
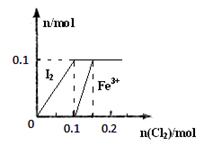
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
参考答案:(14分,每空2分)
(1)C
本题解析:
试题分析:(1)氯气比空气重,需采用向上排空气法收集,氯气有毒,不能排放到空气中,需进行尾气吸收,A集气瓶密封,无法进入气体,错误,B无尾气吸收装置,错误;D气体直接进入NaOH溶液中,发生反应收集不到氯气,错误;选C,氯气通入水中,发生反应Cl2+H2O HCl+HClO,氯水中有Cl2、H2O、H+、Cl-、ClO-、HClO六种微粒,所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
HCl+HClO,氯水中有Cl2、H2O、H+、Cl-、ClO-、HClO六种微粒,所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
(2)工业制备漂白粉的化学反应为2Cl2+2Ca(OH)2 =CaCl2 +Ca(ClO)2+2H2O,漂白粉的成分为CaCl2、Ca(ClO)2,漂白粉与稀盐酸发生复分解反应,离子方程式为H++ClO-=HClO。漂白粉与浓盐酸发生氧化还原反应,离子方程式为2H++ClO-+Cl-=Cl2↑+ H2O。
(3)①根据图可知氯气在通入0.1mol之后开始和Fe2+反应,在0.15mol时反应完全,所以反应掉Cl2 0.05mol Cl2 + 2Fe2+=2Cl-+2Fe3+ Cl2 + 2Fe2+=2Cl-+2Fe3+
0.05 0.1 0.02 0.04 0.04
溶液中所含金属阳离子为Fe2+ :0.1-0.04="0.06mol" , Fe3+ :0.04mol
②根据图和①可知,FeI2的物质的量为0.1mol,则Fe2+:0.1mol, I-:0.2mol,
Cl2+ 2Fe2+=2Cl-+2Fe3+ Cl2 + 2I-=2Cl- + I2
0.05 0.1 0.1 0.1 0.2 0.2 0.1
所以在发生第三个反应之前溶液中Cl-为0.3mol,设第三个反应生成Cl-的物质的量为x mol,根据5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
0.5x x 0.2x (0.3+x)÷(0.2x)="8÷1," 解得x=0.5mol,
通入的Cl2在标准状况下的体积为(0.05+0.1+0.25)×22.4=8.96L。
考点:考查氯气的收集,氯水的成分,漂白粉的化学性质,氯气的性质等知识。
本题难度:困难