微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 温度为T℃,压强为1.01×106 Pa条件下,某密闭容器中发生反应:A(g)+aB(?)  4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是???????????? ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是???????????? ( )
A.第二次平衡时B为气态
B. a>3
C.第一次平衡后增大压强平衡向左移动
D.第三次达到平衡时B为非气态
参考答案:C
本题解析:第一次平衡后,压强增大一倍,气体体积减半,若平衡不移动,则c(A)应为0.4 mol·L-1,而实际上c(A)=0.36 mol·L-1,说明平衡向右移动,即正反应是气体体积减小的反应,故a>3,且B为气态,A、B项均正确、C项错误;第二次平衡后,压强增大到第二次平衡的2.5倍,若平衡不移动,则c(A)应为0.36 mol·L-1的2.5倍,即为0.9 mol·L-1,而实际上c(A)=1.1 mol·L-1,说明平衡向左移动,即逆反应是气体体积减小的反应,故B为非气态,D项正确。
本题难度:一般
2、选择题 X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y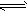 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率为[???? ]
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率为[???? ]
A.33%
B.40%
C.50%
D.66.7%
参考答案:D
本题解析:
本题难度:一般
3、选择题 在一定温度下,固定容积的容器中加入a mol A和b mol B,发生
反应:A(g)+2B(g) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是(?????)
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是(?????)
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-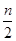 )
)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
参考答案:D
本题解析:
试题分析: D、充入惰性气体(如Ar)增大压强,反应中各组分的浓度并没有发生变化,平衡不移动,错误。
本题难度:一般
4、填空题 (16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+ (g)=CO(g)ΔH1=-126.4kJ/mol????????①
(g)=CO(g)ΔH1=-126.4kJ/mol????????①
C(s)+O2(g)=CO2(g)? ΔH2= -393.5kJ·mol-1???????②
?????????????????S(s)+O2(g)=SO2(g)???ΔH3= -296.8kJ·mol-1?????????③
则SO2氧化CO的热化学反应方程式:??????????????????????????????
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
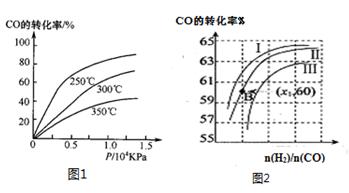
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH?????0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为?????????;测得B(X1,60)点氢气的转化率为40%,则x1=????????。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是??????(填序号)。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E. 混合气体的密度增大
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=??????????????。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O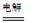 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的?处理过程,其装置示意图如图所示:
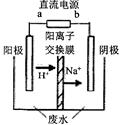
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O;???????????????????????????????????。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇????????kg(计算结果保留2位小数)
参考答案:(16分)
(1) SO2(g)+2CO(g)=S(s
本题解析:
试题分析:(1)根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ·mol-1)×2-(-126.4kJ/mol)×2-(-296.8kJ·mol-1)=-237.4kJ·mol-1,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g)? ΔH=-237.4kJ·mol-1;
(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3测得B(X1,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=40%n/2,所以n/m=3,即x1=3;
②A、增大反应物浓度,正反应速率先增大后减小,说明平衡正向移动,正确;B、增大生成物浓度,逆反应速率先增大后减小,说明平衡逆向移动,错误;C、降低温度,K值增大,说明生成物浓度增大,反应物浓度减小,平衡正向移动,正确;D、减小压强,平衡逆向移动,反应物的体积百分含量增大,错误;E、恒容条件时混合气体的密度增大,说明容器中气体质量增加,可能是反应物也可能是生成物,平衡移动方向不确定,错误,答案选AC;
③设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得:x/(2x-1)=2:1,x=2/3mol/L,所以K=(1-x)/x·(2x-1)2=4.5 L2·mol-2
(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+
②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。
本题难度:一般
5、选择题 25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是(????? )
弱酸化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7? K2=5.6×10-11
A.25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则
c(Na+)-c(CH3COO-)=9.9×10-7mol/L
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等.
C.25℃时,0.1mol/L的各溶液的pH关系pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:C
本题解析:
试题分析:根据25℃时,若同浓度的醋酸和氢氧化钠等体积混合后生成醋酸钠,强碱弱酸盐显碱性。若溶液pH=8,则由c(OH-)×c(H+)="Kw" 和 PH=—lgC(H+)得
c(OH-)-c(H+)=9.9×10-7mol/L?由电荷守恒得c(Na+) + c(H+)? =c(OH_)+c(CH3COO-)
c(Na+)-c(CH3COO-)=9.9×10-7mol/L ,所以A正确;25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等,正确,因为 PH=—lgC(H+) ;NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)这是电荷守恒,所以D正确;
弱酸的电离平衡常数可以看到:醋酸最强,碳酸次之,接下来是氢氰酸,碳酸氢根最弱,所以他们对应的钠盐,PH 的大小关系是pH(Na2CO3)>(NaCN)>pH(CH3COONa),所以C错误。故选C。
点评:这是教学的重难点,也是考试的重点。弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。这个常数叫电离平衡常数,简称电离常数。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单
|