微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。下列说法不正确的是
A.在生活舱中,可用过氧化钠制备氧气
B.金属镁可用作制造飞机、火箭的重要材料
C.在航天试验用的仪器仪表中大量使用了硅等非金属材料
D.返回舱外层的隔热瓦使用的是金属材料
参考答案:D ?
本题解析:航天飞机返回舱外层的隔热瓦使用的是耐高温复合材料,而不是普通的金属材料,故D项不正确。
本题难度:一般
2、填空题 (14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是??????????。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为:?????????????????????????????????。
②精确研究表明,B?-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:?????????????????????、
??????????????????????????????????????;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为:??????????????????????。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极????????????????、负极???????????????。
参考答案:(每空2分共14分)
(1)抑制Fe2+水解
(
本题解析:(1)由于Fe2+易水解生成浑浊,故需要加入相应的酸抑制其水解
(2)在氩气环境中,二价铁不会被氧化;
①结晶水非常加热易失去,再结合图示数据可知AB段确为失去结晶水的过程:FeC2O4·2H2O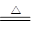 FeC2O4+2H2O
FeC2O4+2H2O
②结合FeC2O4所含有元素及加热所生成的气体只能为CO或CO2,由二者的
本题难度:一般
3、选择题 有关材料分类不正确的是 [???? ]
A.硅酸盐材料属于新型无机非金属材料
B.高温结构陶瓷属于新型无机非金属材料,金属属于金属材料,但都属于结构材料
C.新型无机非金属材料包括半导体材料、光导纤维、氧化铝陶瓷等
D.氮化硅陶瓷属于新型无机非金属材料,但不是高温结构材料
参考答案:AD
本题解析:
本题难度:简单
4、选择题 下列元素的单质在工业上用电解法生产的是
A.氮
B.氯
C.溴
D.碘
参考答案:B
本题解析:
试题分析:A、氮气的主要来源是空气,属于物理变化,A不正确;B、工业上通过电解食盐水得到氯气,B正确;C、单质溴主要从海水中获得,主要是发生氧化还原反应,不需要通过电解法,C不正确;D、同样单质碘主要从海水中获得,主要是发生氧化还原反应,不需要通过电解法,D不正确,答案选B。
本题难度:简单
5、填空题 (12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
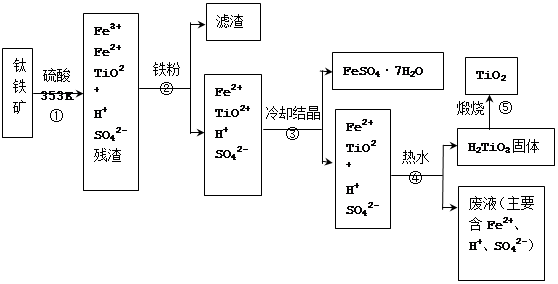
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为?????????????????。
(2)步骤③中,实现混合物的分离是利用物质的??????????(填字母序号)。a. 熔沸点差异 b. 溶解性差异?? c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是??????????????(填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为???????????????????????????????????????????????。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
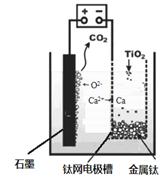
①写出阳极所发生反应的电极反应式:???????????????????????????????????。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)????????????????????????????????????????
参考答案:(1)2Fe3+ + Fe =3Fe2+?(2分)(2)b?
本题解析:(1)铁离子能把铁单质氧化生成亚铁离子,方程式为2Fe3+ + Fe =3Fe2+?。
(2)冷却结晶,有固体析出,因此是利用了物质溶解性的差异,答案选b。
(3)根据流程图可知,三次实验中均产生不溶性物质,所以都需要过滤。
(4)二氧化锰具有氧化性,能氧化废液中的亚铁离子,方程式为MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
(5)①电解池中阳极失去电子,所以根据熔融体中的离子可知,应该是氧离子失去电子,即 2O2- - 4e- = O2↑或
本题难度:一般