微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布结构示意图为: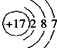
B.纯碱与汽油去除油污的原理相同
C.“84消毒液”中有效成分NaClO的电子式为: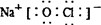
D.蔗糖与醋酸的最简式相同
参考答案:C
本题解析:
试题分析:A、食盐为NaCl,其阴离子为Cl–,Cl–核外电子数为18,核外电子排布式结构示意图为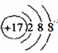 ,错误;B、纯碱去污原理是因为纯碱水解使溶液呈碱性,油污在碱性条件下水解,生成易溶于水的高级脂肪酸钠和甘油,而汽油能去污是因为汽油具有挥发性,汽油溶解油污,共同挥发,所以纯碱与汽油去除油污的原理不相同,错误
,错误;B、纯碱去污原理是因为纯碱水解使溶液呈碱性,油污在碱性条件下水解,生成易溶于水的高级脂肪酸钠和甘油,而汽油能去污是因为汽油具有挥发性,汽油溶解油污,共同挥发,所以纯碱与汽油去除油污的原理不相同,错误
本题难度:一般
2、选择题 氧化还原反应的本质是??????????????????????????????????????????????
A.氧元素的得失
B.化合价的升降
C.电子的转移
D.分子中原子的重新组合
参考答案:C
本题解析:略
本题难度:简单
3、选择题 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
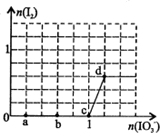
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
参考答案:D
本题解析:
试题分析:向NaHSO3的溶液中加入IO3-溶液,开始没有产生I2,在a点首先碘发生反应:6HSO3-+2IO3- = 6SO42-+2I-+6H+。在该反应中还原剂是NaHSO3,其中被氧化的元素是S元素,错误;B.由于在b点时n(IO3-)=0.6mol,反应消耗HSO3-的物质的量是1.8mol,发生的反应是:6HSO3-+2IO3- = 6SO42-+2I-+6H+。错误;C.c点到d点由于反应产生I2,所以发生的反应是:5I-+IO3- +6H+=3I2+3H2O,根据图像可知产生I2的物质的量是0.6mol。由于发生反应每转移5mol的电子,产生3mol的I2。现在产生0.6mol的I2,所以一共转移1mol电子,错误;D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,由于开始时KIO3过量,所以发生反应6HSO3-+2IO3- = 6SO42-+2I-+6H+产生的I-立即被氧化变为I2,因此开始时总反应的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O,正确。
考点:考查氧化还原反应中电子转移、反应的先后顺序及反应产物的判断的知识。
本题难度:一般
4、填空题 (本题共12分)磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
23.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为____________。
24.写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式______。
25.磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。(请用文字描述)
26.已知磷酸分子中的三个氢原子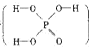 都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
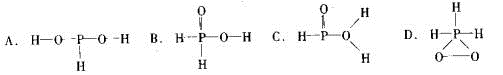
27.次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+_____。请完成并配平上述反应离子方程式。该反应的还原产物是__________,反应中转移1摩尔电子时,理论上产生金属镍______克。
参考答案:23.H<O<P<Na (2分)24.H+ 91eXaM.org
本题解析:
试题分析:23.同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。在NaH2PO2中涉及到Na、H、P、O四种元素中,它们的原子半径由小到大的顺序为H<O<P<Na;
24.与磷同周期的主族元素中,离子半径最小的元素是Al,其最高价氧化物对应水化物Al(OH)3是两性氢氧化物,既可以与酸反应,也可以与碱发生反应,说明其存在两种方式的电离,其电离方程式是H+ + AlO2- + H2O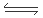 Al(OH)3
Al(OH)3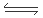 Al3+ + 3OH-;
Al3+ + 3OH-;
25.磷酸二氢钠的水溶液呈酸性的原因是在该物质的水溶液中存在磷酸二氢根离子的电离作用和水解作用,电离是溶液显酸性,水解使溶液显碱性。电离程度大于水解程度;
26.根据题意可知只有羟基H原子可以发生H交换。次磷酸(H3PO2)可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换,说明在H3PO2的分子中只有1个羟基H原子,所以H3PO2的分子结构是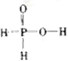 ,选项是B。
,选项是B。
27.根据氧化还原反应中电子守恒及离子反应中的电荷守恒和质量守恒定律可得离子方程式是Ni2++H2PO2-+H2O→ Ni+H2PO3-+2H+ ;在该反应的还原产物是Ni,根据方程式可知每转移2mol的电子,会产生1mol的Ni,若反应中转移1摩尔电子时,理论上产生金属镍的质量是0.5mol×59g/mol=29.5g。
考点:考查元素原子半径的比较、物质的电离方程式的书写、物质结构的推断、反应的离子方程式的书写、氧化还原反应方程式的计算的知识。
本题难度:困难
5、选择题 MgCl2?xH2O的晶体2.03g与足量的硝酸银溶液反应,生成沉淀0.02mol,则MgCl2?xH2O晶体中x的数值是
( )
A.2
B.4
C.6
D.8
参考答案:发生反应:MgCl2+2AgNO3=2AgCl↓+Mg(NO
本题解析:
本题难度:一般