微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( ?? )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
参考答案:C
本题解析:
试题分析:A、还原性的强弱与失去电子数目的数目多少无关,只决定于失去电子数目的难易程度,故A错误;B、阳离子的氧化性越强,对应单质的活泼性越差,故B错误;C、甲能与盐酸反应放出氢气,说明在金属活动性顺序表中,排在氢的前面,乙不能与盐酸反应放出氢气,在金属活动性顺序表中,排在氢的后面,故甲的活动性比金属乙强,故C正确;D、将甲、乙作电极构成原电池时,活泼的做负极,故活泼性乙大于甲,D错误;故选C。
本题难度:一般
2、简答题 有效地利用现有新能源和开发新能源已受到各国的重视.
(1)可用改进汽油组成的办法来改善汽油的燃烧性能.例如,在汽油中加入乙醇来生产“无铅汽油”.乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式______.
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一.能说明甲烷是正四面体而非正方形平面结构的理由是______.(填写编号,多选倒扣分)
①其一氯取代物不存在同分异构体?? ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体??????????????④其四氯取代物不存在同分异构体
(3)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.通入CH4的一极电极反应式是:CH4+10OH--8e-=CO32-+7H2O;通入O2的一极,其电极反应式是______.已知4g甲烷完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则甲烷燃烧的热化学方程式为______;
(4)氢能是人类未来的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列既可供开发又消耗较低经济的制氢方法是______(填写编号,多选倒扣分)
①电解水????? ②锌和稀硫酸反应????? ③光解海水
其次,制得纯氢气后,还需要解决的问题是______.(写出其中的一个)
参考答案:(1)根据碳的四价键结构、氧的二价键架构,C2H6O所有可能
本题解析:
本题难度:一般
3、填空题 (16分)工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol
|
0 min
| 2min
| 4min
| 6min
|
CH4
| 2.00
| 1.76
| 1.60
| n2
|
H2
| 0.00
| 0.72
| n1
| 1.20
根据表中数据计算:
①0 min~2min内H2的平均反应速率为 。
②达平衡时,CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
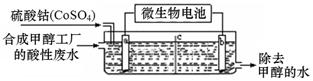
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。
参考答案:(1)ad (2)① 0.18mol·L-1·mi
本题解析:
试题分析:本题为涵盖多知识点的综合题,各知识点之间相互独立。(1)根据化学反应的焓变确定为吸热反应,结合盖斯定律可知a、d正确,c项生成的水为液体,放热大于131.4kJ/mol;
(2) CH4(g) + H2O(g) CO(g) + 3H2(g) CO(g) + 3H2(g)
初始量(mol)2.00 1.00 0 0
变化量(mol)0.40 0.40 0.40 1.20
4min时(mol)1.60 n1
6min时(mol)n2 1.20 所以反应4min时达平衡,此时 CH4的转化率为20%;平衡时再冲入2.00mol甲烷和1.00mol水蒸气,物质的转化率降低,导致达到新平衡时H2的体积分数比原平衡小;(3)由题给信息确定a极发生氧化反应,所以为阳极;微生物电池为酸性,所以H+参与正极反应,氧气在该电极发生还原反应,不难确定电极反应式。
考点:化学反应的能量变化、化学反应速率、转化率的计算、原电池、电解池。
本题难度:困难
4、选择题 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室?进行实验验证,
他们设计组装了如图所示装置,已知a为石墨电极;b为铁电极;c为铝电极(已除去表面氧化膜);d为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转.下列判断正确的是( )
A.b为负极,d为阳极
B.一段时间后,a和d电极附近溶液变红
C.b电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失
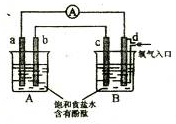
参考答案:右边装置中有较活泼的金属铝、导电的非金属石墨和电解质溶液,且
本题解析:
本题难度:一般
5、选择题 如图所示的原电池装置,观察到电流表指针有明显偏转.下列说法中不正确的是( )
A.原电池装置能将化学能转变为电能
B.原电池的反应本质是氧化还原反应
C.锌失去电子发生还原反应,电子沿导线流向铜
D.在铜片表面产生大量气泡
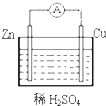
参考答案:A、原电池是化学能转化为电能的装置,故A正确;
B、原
本题解析:
本题难度:简单
|