微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式???????????????????????????
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:???????????????????????????
(4)假设没有Fe,生活会?????????????????
假设没有Al,生活会??????????????????
假设没有Si,生活会??????????????????
2、实验题 (6分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
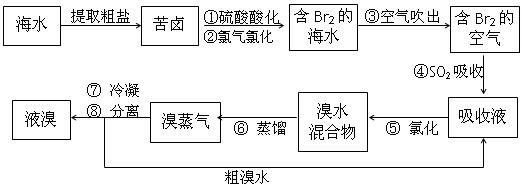
(1)步骤①中用硫酸酸化可提高Cl2的利用率,为什么??????????????????。
(2)步骤④的离子方程式:________________________________________。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离仪器的名称是_____________
(4)提取时要经过“空气吹出、SO2吸收、氯化”的过程的目的是:?????????????????。
3、填空题 海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为??????????????????????;与其同周期相邻且单质为固体的元素原子的核外电子排布式为???????????????????。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为????????(用离子符号表示),其中形成的化合物中能发生潮解的是???????????????????(用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式:?????????????????????????????????????。
②Be(OH)+与强碱溶液反应的离子方程式:???????????????????????????????????。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是?????(选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气
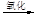
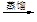 液溴
液溴
b.海水提镁:海滩贝壳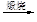
 石灰乳
石灰乳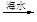

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐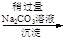
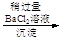
 滤液
滤液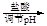
 食盐晶体
食盐晶体
4、选择题 “白色污染”是环保治理的一个重要方面,“白色污染”是指工业或生活中排放或废弃的(???)
A.工业废气
B.工业废水
C.矿渣
D.塑料
5、填空题 (12分)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
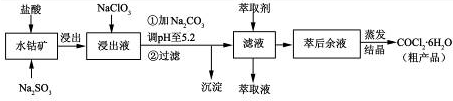
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| Mn(OH)2
|
开始沉淀
| 2.7
| 7.6
| 7.6
| 4.0
| 7.7
|
完全沉淀
| 3.7
| 9.6
| 9.2
| 5.2
| 9.8
(1)写出浸出过程中Co2O3发生反应的离子方程式???。
(2)NaClO3的作用是???。
(3)加Na2CO3调pH至5.2所得沉淀为???。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是???;其使用的适宜pH范围是???。
A.2.0~2.5?? B.3.0~3.5? C.4.0~4.5
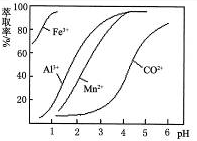
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是???。(答一条即可)
|