微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Cu—Zn原电池的说法正确的是
A.在原电池中,电子流出的一极为负极
B.原电池中,发生还原反应的电极是负极
C.原电池中,电流的方向是从负极到正极
D.在Cu—Zn原电池中,Cu做负极
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应,所失去的电子经导线传递到正极上,而电流方向和电子流向正好相反。所以正确的答案是A。
本题难度:简单
2、填空题 甲醇(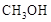 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的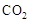 可制取甲醇,其反应为:
可制取甲醇,其反应为: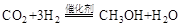
常温常压下已知下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了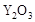 的
的 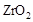 晶体,在高温下它能传导
晶体,在高温下它能传导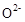 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
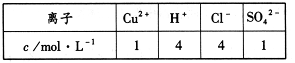
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将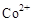 氧化成
氧化成 ,然后以
,然后以 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成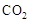 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为: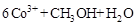
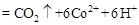 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L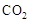 时,共转移电子 mol。
时,共转移电子 mol。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)左图中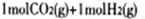 转化为
转化为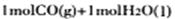 时能量变化为-41 Kl·mol-1,右图中
时能量变化为-41 Kl·mol-1,右图中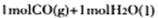 转化为
转化为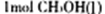 时能量变化为:419 Kl·mol-1—510 Kl·mol-1= -9Kl·mol-1,则由二氧化碳和氢气制备甲醇的能量变化为-41 Kl·mol-1+(-9Kl·mol-1)=—50 Kl·mol-1
时能量变化为:419 Kl·mol-1—510 Kl·mol-1= -9Kl·mol-1,则由二氧化碳和氢气制备甲醇的能量变化为-41 Kl·mol-1+(-9Kl·mol-1)=—50 Kl·mol-1
(2)为提高甲醇燃料的利用率,在燃料电池的一个电极通入空气,此时空气作为正极,而甲醇气体作为负极,正极反应式为: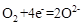 。当两极收集到相同体积(相同条件)的气体时,说明电解过程分别产生了O2、Cl2、H2,则此时阳极上收集到氧气的物质的量为0.1mol。
。当两极收集到相同体积(相同条件)的气体时,说明电解过程分别产生了O2、Cl2、H2,则此时阳极上收集到氧气的物质的量为0.1mol。
(3)由题意,通电后将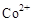 氧化成
氧化成 说明
说明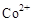 所在的电极为阳极,则阳极反应式为:
所在的电极为阳极,则阳极反应式为: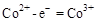 ,CH3OH作为阴极,被氧化,其中被氧化的是甲醇中的C元素,当产生标准状况下2.24L
,CH3OH作为阴极,被氧化,其中被氧化的是甲醇中的C元素,当产生标准状况下2.24L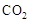 时,说明共产生了0.1mol
时,说明共产生了0.1mol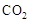 ,则共转移电子0.6 mol。
,则共转移电子0.6 mol。
考点:化学能源、燃料电池、离子反应
点评:将有机化合物制作成相应的燃料电池,符合绿色化学与可持续发展理念,此种类型的题目为高考重要考点,体现了化学与生活息息相关,也加强了学生的化学设计与探究意识。
本题难度:一般
3、选择题 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。下列说法中不正确的是
A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl—
B.该电池的负极反应为4Li = 4Li+ + 4e—
C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应
D.组装该电池必须在无水的条件下进行
参考答案:A
本题解析:A、负极发生氧化反应,为4Li-4e-=4Li+,错误;B正确;
C、没有化合价的改变,为非氧化还原反应。
D、因为SOCl2与水发生水解反应,故在无水条件下进行。
本题难度:困难
4、选择题
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
参考答案:B
本题解析:随着生产的发展和人们生活水平的提高,环境污染和环保问题已越来越受到人们重视,废电池中含有汞等多种重金属离子,极易对环境造成污染。
本题难度:简单
5、选择题 (10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3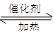 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)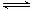 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
2NO(g)+O2(g)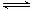 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
则反应NO2(g)+SO2(g)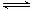 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
参考答案:(共10分)
(1)6.72(3分)
(2)-
本题解析:
⑴NO2在标准状况下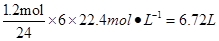
⑵①2SO2(g)+O2(g)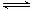 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
②2NO(g)+O2(g)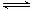 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
(①
本题难度:困难