微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为达到预期的实验目的,下列操作正确的是[???? ]
A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
参考答案:C
本题解析:
本题难度:一般
2、实验题 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2?g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出)
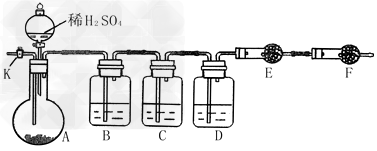
(1)将仪器连接好以后,必须进行的第一步操作是:___________________??????????
(2)此实验还必须用到的最重要的仪器是________________________;仪器F的作用是______________________。
(3)已知仪器C中装有品红溶液,其作用是_________________________。
(4)实验室中备有以下常用试剂:a.浓硫酸;b.品红溶液;c.酸性高锰酸钾溶液;d.饱和碳酸氢钠溶液;e.氢氧化钠溶液;f.无水硫酸铜;g.碱石灰;h.五氧化二磷;i.无水氯化钙。
请将下列容器中应盛放的试剂序号填入相应空格:
B中______,D中_________,E中__________。
(5)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中缓慢通入大量的空气。这样做的目的是_________________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_______(填“偏高”、“偏低”或“没影响”)。
(6)若仪器E在实验完成时增重4.4?g,则Na2CO3与Na2SO3的物质的量之比为______。
参考答案:(1)检查装置的气密性
(2)托盘天平;防止空气中的水
本题解析:
本题难度:一般
3、实验题 在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2+ +8H+ + MnO4-=5Fe3+ +Mn2+ +4H2O。
高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42- +2MnO4-+16H+=10CO2↑+2Mn2+ +8H2O
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2 mol· L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经标定c(KMnO4)=1.6×10-2 mol·L-1。
步骤三:称取FeSO4·7H2O试样1.073 g,放人锥形瓶中,加入适量的水溶解。
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00 mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、____、____。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是________________。
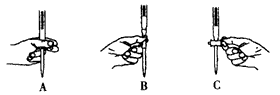
(3)本实验中操作滴定管的以下图示,正确的是__________(填编号)。
(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_____________。
(5)请设步骤二中的数据记录和数据处理表格__________(不必填数据)。
(6)国家标准规定FeSO4·7H2O的含量(w):
一级品100. 5%≥w≥99.50%;
二 级品100.5%≥w≥99.00%;
三级品101.0%≥w≥98.00%。
试判断该试样符合国家___________级品标准。
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是_______________。
参考答案:(1)量筒 ;玻璃棒
(2)根据反应的定量关系、滴定
本题解析:
本题难度:困难
4、选择题 某同学在实验报告中记录下列数据,其中正确的是 [???? ]
A.用25mL量筒量取22.36mL盐酸
B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶配制450mL溶液
D.用广泛pH试纸测得某溶液的pH为3
参考答案:CD
本题解析:
本题难度:简单
5、实验题 某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗固定在铁架台上;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.压住分液漏斗玻璃塞倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开,或使玻璃塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填空):______→______→_____A→G→____→ E→F。
(2)上述E步骤的操作中应注意_______________上述G步骤操作的目的是________________。
(3)能选用CCl4从碘水中萃取碘的原因是______________________。
参考答案:(1)C;B;D;H
(2)应使漏斗下端管口紧靠承接
本题解析:
本题难度:一般