微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氨基甲酸铵常用于生产医药试剂、发酵促进剂、电子元件等,是一种可贵的氨化剂。某学习小组研究在实验室中制备氨基甲酸铵的化学原理。
(1)将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强(kPa)
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度 (10-3mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
①上述反应的的焓变:?H 0,熵变?S 0(填“>”、“<”或“=”)
根据表中数据,计算出25.0℃时2NH3(g)+CO2(g)  NH2COONH4(s)的化学平衡常数K= 。 NH2COONH4(s)的化学平衡常数K= 。
③若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将 (填“增大”、“减小”或“不变”)。
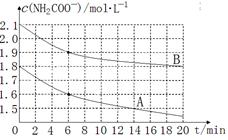
(2)氨基甲酸铵极易水解:NH2COONH4+2H2O  NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。 NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
参考答案:(1)①<,<(各2分,共4分)
②K=6.10×10
本题解析:
试题分析:(1)①从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0;
②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3 mol·L-1、1.6×10-3 mol·L-1,代入平衡常数表达式:K=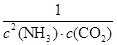 = =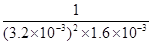 =6.10×107(L·mol-1)3; =6.10×107(L·mol-1)3;
③若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,氨基甲酸铵是固体,取出少量,化学平衡不移动,反应物的转化率将不变(2分)
(2) A 曲线所对应的实验温度高, A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高。
考点:考查化学平衡。
本题难度:困难
2、选择题 某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
A.△H<0,△S>0
B.△H<0,△S<0
C.△H>0,△S>0
D.△H>0,△S<0
参考答案:C
本题解析:
试题分析:化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行。当△H<0,△S>0时,△G=△H-T?△S<0,在室温一定能自发进行;而△H>0,△S<0时不能自发进行;当△H>0,△S>0时,在室温下不能自发进行,在高温下能自发进行;当△H<0,△S<0时,在室温下能自发进行,在高温下不能自发进行。因此如果某反应在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S均大于0,答案选C。
考点:考查反应自发性的判断
本题难度:一般
3、填空题 如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为???????????????????,反应在10分钟内的化学反应速率用Z来表示则V(Z)=??????????????。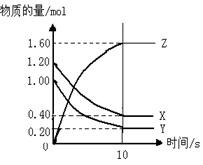
参考答案:(6分)???? X+Y 本题解析: 本题解析:
试题分析:反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则反应中消耗n(X)=0.8mol,n(Y) =0.8mol,所以该反应的化学方程式可表示为X+Y 2Z;反应在10分钟时Z的物 2Z;反应在10分钟时Z的物
本题难度:一般
4、填空题 T1温度下,反应2SO2(g)+O2(g)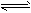 2SO3(g) △H<0的平衡常数K=532.4。 2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K= ,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)="0.0600" mol·L-1,c(O2)="0.400" mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为 。
(2)该反应△S 0,升高温度,平衡常数 (填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
容器
| 甲
| 乙
| 反应物投入量
| 2molSO2、1molO2
| 4molSO3
| 平衡时n(SO3)/mol
| 1
| m
| 反应物的转化率
| ?1
| ?2
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是 。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,?1+?2 1(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。
参考答案:(12分)(1)c2(SO3)/c2(SO2)c(O2),逆
本题解析:
试题分析:(1)c2(SO3)/c2(SO2)c(O2)= 2.0002/(0.06002×0.400)=2778>532.4,平衡向逆反应方向移动;(2)反应是一个体积减小的反应,该反应△S<0;△H<0,升高温度,平衡向逆反应方向移动,平衡常数减小;(3)①A、SO2、O2、SO3的物质的量浓度不再变化,物质的量浓度之比为2:1:2,达到平衡状态;B、反应是一个体积减小的反应,容器内气体压强不再变化,达到平衡状态;C、单位时间内2v(SO2)消耗= v(O2)生成 ,正逆反应速不相等,没有达到平衡状态;D、密闭容器中,质量守恒,密度不变,不能说明达到平衡状态;答案选AB。②若在容器乙中投入2mol SO3 ,?1+?2=1,投入4molSO3 ,压强增大,平衡右移?2减小,?1+?2<1;T2时平衡常数为12/(12×0.5)=2小于532.4,所以T1<T2。
考点:化学平衡常数
本题难度:一般
5、选择题 某反应吸热(ΔH>0),在常温下能自发进行,则该反应的ΔS
A.可能大于0
B.可能小于0
C.肯定大于0
D.肯定小于0
参考答案:C
本题解析:考查化学反应进行的方向。根据△G=△H-T·△S可知,若反应是吸热反应,即△H>0时,反应在常温下能自发进行,因此只有△S小于0,才能满足△G小于0,答案选C。
本题难度:简单
|
|