微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
 压强(Mpa) 压强(Mpa)
 氨的平 氨的平
衡含量(%)
温度(℃)
| 0.1
| 10
| 20
| 30
| 60
| 100
|
200
| 15.3
| 81.5
| 86.4
| 89.9
| 9 5.4 5.4
| 98.8
|
300
| 2.2
| 52.0
| 64.2
| 71.0
| 84.2
| 92.6
|
400
| 0.4
| 25.1
| 38.2
| 47.0
| 65.2
| 79.8
|
500
| 0.1
| 10.6
| 19.1
| 26.4
| 42.2
| 57.5
|
600
| 0.05
| 4.5
| 9.1
| 13.8
| 23.1
| 31.4
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
?
| 反应速率
| 平衡常数K
| 氨的体积分数
| 变化情况
| ?
| ?
| ?
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。| A.0.3mol | B.0.15mol | C.小于0.15mol | D.大于0.15mol,小于0.3mol
参考答案:(1)(1分)放热。
(2)(2分)压强过大,需要的动
本题解析:略
本题难度:一般
2、选择题 有关化工生产原理说法正确的是( )
A.工业上制粗硅:SiO2 + C Si + CO2↑ Si + CO2↑
B.海水提镁的主要步骤为
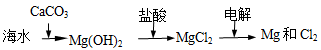
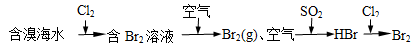
C.海水提溴原理
D.硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器
参考答案:C
本题解析:
正确答案:C
A、SiO2+C 2CO↑+Si 2CO↑+Si
B 电解MgCl2的水溶液得不到Mg,应电解无水MgCl2
C 正确
D、氯碱工业的电解槽没有热交换器
本题难度:简单
3、填空题 硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产。硝酸工业生产流程图如下图所示:
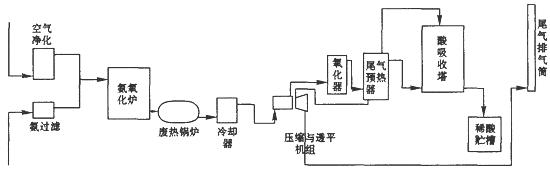
(1)第—步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式??????????。
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生该反应的化学方程式??????????????????????,该过程是放热的,为了使吸收效果更好,在吸收过程中需要控制在???????????????????条件下。
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题?????????????????。工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式??????????????????????。
参考答案:
(1)4NH3+5O2 本题解析: 本题解析:
试题分析:(1)氨气的催化氧化,反应方程式是:4NH3+5O2 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3
本题难度:一般
4、选择题 工业生产中物质制备时,通过下列的反应原理一步完成获得产物,符合“绿色化学”原则的反应原理是( )
A.加成反应
B.分解反应
C.取代反应
D.置换反应
参考答案:A
本题解析:
本题难度:一般
5、填空题 (17分) 重庆有丰富的天然气资源。以天然气为原料合成氨的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
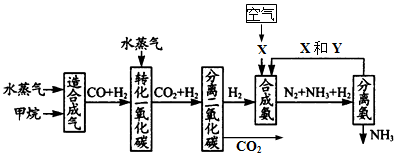
请填写下列空白:
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是_______________________________。
(2)图中X为_____,Y为_____(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为_____________________________________
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来。请运用化学平衡的观点说明采取该措施的理由:_______________________________。
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图所示
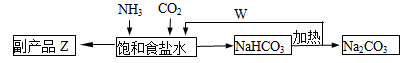
①应先向食盐水通足量_______气体(写化学式,后同);副产品Z为______,可用作______;W为_______。
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z_______吨。
参考答案:(17分)
(1)CH4 (g) + H2O (g)
本题解析:略
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772