微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH+3O2+4OH-  ?2CO32-+6H2O,则下列说法正确的是? [???? ]
?2CO32-+6H2O,则下列说法正确的是? [???? ]
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
E.充电时每生成1 mol CH3OH转移12mol电子
参考答案:D
本题解析:
本题难度:一般
2、选择题 以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4mol? Fe(OH)3沉淀,此间共消耗的水的物质的量为
A.8mol
B.10mol
C.11mol
D.12mol
参考答案:B
本题解析:略
本题难度:一般
3、选择题 用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:

电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是
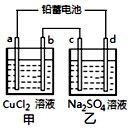 [???? ]
[???? ]
A.d极为阴极
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C.若利用甲池精炼铜,b极应为粗铜
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
参考答案:C
本题解析:
本题难度:一般
4、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ Ni(S)+4CO(g)
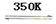 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ Ni(CO)4(g)  Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。

①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
参考答案:(1)①增大CO浓度,加压。(各1分共2分)
②0.0
本题解析:
试题分析: (1)要提高反应Ⅰ中Ni(CO)4的产率,就是要使平衡正向移动,因此除了改变温度以外,还可以适当增大压强、增大CO的初始浓度。
(2)①反应至10min时,固体Ni的质量减小了100-41=59g,所以反应的n(Ni)= 59g/59g/mol=1mol,所以生成的Ni(CO)4)也为1mol,所以v(Ni(CO)4)="1/(10×2)" mol·L-1min-1=0.05mol·L-1min-1。
②反应十分钟达平衡,右端得到29.5g的纯镍,是发生了反应II,所以此处为干扰信息,所求的反应I的平衡常数与反应II无关,因此计算过程如下:
Ni(S)+4CO(g)
 Ni(CO)4(g)
Ni(CO)4(g)
起始(mol) 6 0(1分)
变化(mol) 1 4 1(1分)
平衡(mol) 2 1(1分)
平衡(mol/L) 1 0.5
K = c[Ni(CO)4]/c4(CO) = 0.5/14 = 0.5(2分)
(3)反应II为反应I的逆过程,所以反应II中的△H2 >0;达到平衡后降低温度,平衡逆向移动,因此分析如下:温度降低,平衡逆向移动,平衡常数K变小,a错误;平衡逆向移动,CO的浓度减小,Ni的质量减小,bc正确;温度降低正逆反应速率均减小,D错误。
(4)从电池充放电总反应式来看,NiO(OH)→ Ni(OH)2 中Ni的化合价+3→+2,发生还原反应,所以放电时作正极。相反,当充电时Ni(OH)2→NiO(OH)时,Ni(OH)2 应该作阳极发生氧化反应,因此反应的电极反应式为:Ni(OH)2+OH?-e-="NiO(OH)+" H2O,而充电时的阴极发生还原反应。
考点:本题考查的是反应原理知识、反应速率和K的计算、电化学基础知识。
本题难度:困难
5、选择题 用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解,此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8mol
D.原某浓度的NaCl溶液中溶有117g NaCl
参考答案:C
本题解析:略
本题难度:简单