微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是(???)
3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是(???)
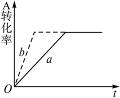
图2-28
A.增大A的浓度
B.扩大容器的容积
C.加入催化剂
D.升高温度
参考答案:C
本题解析:由图象可知,曲线a变为b,只是缩短了反应到达平衡的时间,而A的转化率并没有改变。所以A项,增大A的浓度则A的转化率应降低。B项,扩大容器容积,而此反应是反应前后气体的总物质的量不变的反应,所以平衡不移动,则A的转化率不变,但是,反应达到平衡所用时间更长。C项,加入催化剂平衡不移动,A的转化率不变。D项,升高温度,平衡向左移动,A的转化率应降低。
本题难度:简单
2、实验题 下表是稀硫酸与某金属反应的实验数据:
实验序号
| 金属质量/g
| 金属状态
| c(H2SO4)
/mol·L-1
| V(H2SO4)
/mL
| 溶液温度/℃
| 金属消失的时间/s
|
反应前
| 反应后
|
1
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
|
2
| 0.10
| 块状
| 0.8
| 50
| 20
| 35
| 200
|
3
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
|
4
| 0.10
| 块状
| 1.0
| 50
| 20
| 35
| 125
分析上述数据,请回答下列问题。
(1)实验1和3表明,??????????????对反应速率有影响,能表明这种影响因素的实验还有????????????(填实验序号)。
(2)本实验中影响反应速率的其他因素还有?????????,其实验序号是???????。该实验说明???????????????,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
????????????????????????????????????????????????????????????????????????????。
参考答案:(7分)(1)硫酸的浓度,实验2、4
(2)固体反应物
本题解析:
试题分析:影响化学反应速率的因素很多:
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率越慢;反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低。
(1)观察实验1和3,金属的质量和金属的状态,溶液的温度均是相同的,但稀硫酸的浓度不同,可知稀硫酸的浓度对
本题难度:一般
3、选择题 把铁放入盛有盐酸的试管中,不影响氢气产生速率的是
A.盐酸的浓度
B.用铁粉代替铁片
C.增大压强
D.溶液的温度
参考答案:B
本题解析:
试题分析:影响反应速率的因素:浓度、压强、温度、催化剂等。A、增加盐酸的浓度,加快反应速率;B、铁是固体,固体的浓度是常数;C、有氢气,增大压强加快反应速率;D、温度,影响反应速率。
考点:考查影响反应速率的因素。
本题难度:一般
4、选择题 对于某容器中一定条件下进行的反应N2+3 H2 2NH3,能增大化学反应速率的措施是? 2NH3,能增大化学反应速率的措施是?
[???? ]
A.保持其他条件不变,恒压下,通入3 mol Ne
B.保持其他条件不变,压缩容器体积使压强增大到原来的2倍
C.保持其他条件不变,恒容下,通入Ar使压强增大到原来的2倍
D.保持其他条件不变,将容器的体积扩大一倍
参考答案:B
本题解析:
本题难度:一般
5、填空题 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。

当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是__________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是___________________________。
参考答案:(1)BD
(2)Cu(s)+H2O2(l)+2H+
本题解析:
本题难度:一般
|