微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g)△H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
参考答案:BC
本题解析:
试题分析:4Al (s)+3O2(g)
本题难度:一般
2、选择题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1?mol产物时的能量变化).下列叙述正确的是
 [???? ]
[???? ]
A.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)==2PCl3(g)?;ΔH=-306?kJ/mol
B.PCl5分解生成PCl3和Cl2的热化学方程式为:PCl5(g)==PCl3(g)+Cl2(g);ΔH=-93?kJ/mol
C.P和Cl2分两步反应生成1?mol?PCl3的ΔH大于306?kJ/mol ?
D.P和Cl2分两步反应生成1?mol?PCl5的ΔH等于399?kJ/mol
参考答案:D
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
参考答案:(每空2分,共14分)
(1) 1s22s22p63s
本题解析:
试题分析:由A的电子层结构,可以推知为2s22p3,为N,又B和E为同一主族,C、D、E为同周期,B为O或F,C、D、E为第三周期,外层有一个未成对电子的可能为Na和Al,从而确定B为O、E为S。
(1)要注意为S的离子
(2)原子半径先比较电子层,电子层越多半径越大,再比较核电荷数,越多半径越小
(3)第一电离能整体上同周期从左到右为增大趋势,同主族从上到下,减小;这里N为半充满,反常。
(4)Na2O2的电子式
(5)Al的位置以及制备Al(OH)3,要考虑氢氧化铝的两性,既能溶于酸又能溶于碱,故不能用强碱,用氨水。
(6)由盖斯定律有目标反应等于①×2+②+③×2
考点:以物质结构为基础,考查了原子结构、元素周期表和周期律、盖斯定律和热化学方程式的书写。
本题难度:困难
4、选择题 下列关于反应热的描述中正确的是 ( )

参考答案:B
本题解析:A 错 中和热是强酸与强碱的稀溶液反应生成1mol水时,不能生成沉淀,所放出的热量
B 对 把CO的燃烧的热化学方程式写出,然后乘以2,反应物和生成物颠倒,即可得后面的热化学方程式,反应热也跟随其变化可得
C 错 热化学方程式的系数缩小一倍即可,反应热不变
D 错 必须生成液态水,不是气态水
本题难度:一般
5、填空题 现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
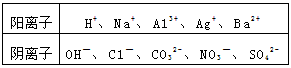
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)写出D为_________________
(2)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子的浓度由大到小的顺序为:______________________。
(3)写出E溶液与过量的B溶液反应的离子方程式______________________。
(4)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1);△H=-a kJ·mol-1。请写出B与C的稀溶液反应的热化学方程式______________________。
(5)在100mL 0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1 NaOH溶液,最终得到沉淀物质的量为
___________________。
参考答案:(1)AgNO3
(2)c(Na+)>c(C1-
本题解析:
本题难度:一般