微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.溶液的pH值越小,其中含有的氢离子就越多
B.物质的水溶液浓度越高,密度越大
C.单质的化学活动性越强,氧化性也越强
D.相同条件时,酸性越弱的酸,其对应的钠盐的水溶液碱性越强
参考答案:D
本题解析:
本题难度:简单
2、选择题 与100 mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同的是
A.200 mL 0.1 mol/L NH4Cl 溶液
B.50 mL 0.2 mol/L NH4NO3溶液
C.100 mL 0.2 mol/L NH4HSO4
D.50 mL 0.2 mol/L氨水
参考答案:B
本题解析:
试题分析:100 mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)近似为0.2mol/L :A. 200 mL 0.1 mol/L NH4Cl 溶液中c(NH4+)近似为0.1 mol/L,故A错误。B . 50 mL 0.2 mol/L NH4NO3溶液c(NH4+)近似为0.2 mol/L,故B正确。C. 100 mL 0.2 mol/L NH4HSO4 c(NH4+)由于受H+的抑制作用,大于 0.1mol/L (NH4)2SO4溶液中c(NH4+),故C错误。D. 50 mL 0.2 mol/L氨水c(NH4+)远小于0.2 mol/L,故D错误。
考点: 了解离子浓度的简单计算,了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
点评:本题涉及的知识点有溶液中某离子浓度的求算方法,盐的水解及影响因素,弱电解质的电离。
本题难度:一般
3、选择题 常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)=c(CH3COO-)
C.氢氧化钠和醋酸的浓度不相等
D.混合后的溶液呈中性
参考答案:A
本题解析:试题分析:A、醋酸是弱酸,存在电离平衡,pH=4的醋酸溶液中氢离子浓度是10-4mol/L。常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,这说明醋酸浓度等于强碱氢氧化钠的浓度,即醋酸的浓度是10-4mol/L,所以混合前的醋酸约有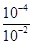 ×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。
×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。
考点:考查醋酸与氢氧化钠溶液中和后溶液酸碱性判断以及离子浓度大小比较
本题难度:困难
4、选择题 常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y->CO32->X->HCO3-
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+)
参考答案:B
本题解析:
试题分析:A.根据复分解反应的规律:强酸制取弱酸,向一元弱酸HX如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3可得酸性H2CO3>HX,向往NaY溶液中通入少量CO2生成HY和Na2CO3则证明酸性HCO3-> HY,则酸性H2CO3>HX>HCO3-> HY,所以选项A错误;酸性越强,其电离产生的离子结合H+的能力就越强,所以结合H+的能力大小关系是:Y->CO32->X->HCO3-,正确;C.酸越强,其盐水解的程度就越小,溶液的碱性就越弱,由于酸性H2CO3>HX>HCO3-> HY,所以溶液碱性:NaY>Na2CO3>NaX>NaHCO3,错误;D.NaX溶液中通入足量CO2后的溶液为NaHCO3和HX。由于盐是强电解质,电离程度大于弱电解质HX,而且HCO3-会发生水解反应消耗水电离产生的H+,使溶液中c(OH-)>c(H+),CO2溶于水反应产生碳酸,即HX电离使溶液显酸性,所以离子浓度:c(Na+)>c(HCO3-)>c(H+)>c(X-)>c(OH-),错误。
考点:考查溶液中离子浓度大小比较的知识。
本题难度:困难
5、选择题 蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3
B.FeCl3·6H2O
C.Fe(OH)3
D.Fe2O3
参考答案:D
本题解析:FeCl3在水中发生水解:FeCl3+3H2O Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
本题难度:一般