微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
参考答案:A
本题解析:
试题分析:A、HCl溶液中氢离子的物质的量小于氢氧化钡溶液中氢氧根离子的物质的量,所以溶液显碱性,则溶液中氢氧根离子的浓度=(10×2-10)mL×0.02mol/L/20mL=0.01mol/L,则氢离子的浓度是10-12mol/L,所以溶液的pH=12,正确;B、Ksp也是平衡常数,isUI温度变化而变化,但温度不变,溶度积不变,错误;C、醋酸钠溶液中,醋酸根离子水解生成醋酸和氢氧根离子,所以根据质子守恒,c(OH-)=c(CH3COOH)+c(H+),错误;D、常温下pH=4的NaHC2O4溶液为酸性溶液,则HC2O4-的电离程度大于其水解程度,电离产生C2O42-,水解产生H2C2O4,所以c(H2C2O4)<c(C2O42-),错误,答案选A。
考点:考查酸碱混合pH的计算,溶度积的判断,电解质溶液中离子浓度的判断
本题难度:一般
2、选择题 在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中 [???? ]
A.Br-浓度降低
B.Ag+浓度降低
C.Kw减小
D.Ksp(AgBr)增大
参考答案:A
本题解析:
本题难度:一般
3、填空题 (18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: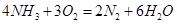 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b. 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液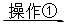 白色沉淀
白色沉淀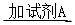 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。

(3)已知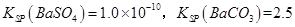
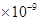 。某同学设想用下列流程得到BaCl2,
。某同学设想用下列流程得到BaCl2,
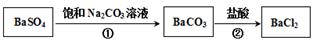
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生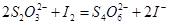 反应
反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
参考答案:(1)2NH3-6e-+6OH-=N2+6H2O;bd。(2
本题解析:
试题分析:(1)氨气燃料电池中氨气中的氮元素化合价升高,在负极反应,所以负极的电极反应为:2NH3-6e-+6OH-=N2+6H2O;a电解装置不可能将电能全部转化为化学能,还有热能,错误;b硫酸根离子在电解精炼中没有反应,不变,正确;c铜离子向阴极移动,错误;d阳极上比铜活波的金属反应,比铜不活波的金属会作为阳极泥落下来,正确;e阳极是铝、锌等先反应,所以阳极质量减少了64克,不是铜减少了64克,不能计算转移电子数,错误。所以选bd。(2)①所得的悬浊液经过过滤得到白色沉淀,在加入盐酸看沉淀是否溶解,若未溶解,说明反应过程中二氧化硫被氧气氧化成了硫酸根离子,所以反应的离子方程式为:2SO2+2Ba2++O2+2H2O=2BaSO4+4H+。②若用电解法吸收尾气中的二氧化硫,则二氧化硫在阳极失去电子变成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-(3)因为Ksp(BaSO4)<Ksp(BaCO3),所以硫酸钡可以转变成碳酸钡,BaSO4(s)+CO32-(aqs)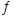 BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
考点:电解精炼,难溶电解质的转化,氧化还原反应
本题难度:困难
4、选择题 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
[???? ]
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:B
本题解析:
本题难度:一般
5、选择题 将足量BaCO3(Ksp=8.1×10-9) 分别加入:①30mL 水 ②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为 [???? ]
A.①②③④
B.③④①②
C.④③①②
D.②①④③
参考答案:B
本题解析:
本题难度:一般