499
常温下,N2与H2O反应生成NH3的热化学方程式为_______________________。
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,υ(H2C2O4)=____________。
(5)如果反应从开始进行一段时间后,速率—时间图像如图: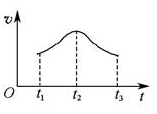 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
参考答案:(I)(1)太阳?? 1分,化学? (1分)。???(2)△
本题解析:
试题分析:(I)(1)根据转化示意图可知,过程I是利用太阳能将氮气、水和CO2等转化为氢气、氧气、氨气、甲醇和甲烷等,因此能量转化是太阳能转化为化学能。
(2)过程Ⅱ是在一定条件下氢气、氧气、氨气、甲醇和甲烷等又重新转化为CO2、水和氮气等,所以根据能量守恒可知△H1=-△H2。
(3)根据原子守恒可知,氮气与水反应生成氨气的同时还有氧气生成,反应的化学方程式为2N2+6H2O 本题难度:简单 本题难度:简单
2、选择题 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量,已知12克石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是(??)
A.Q1<Q2
B.石墨不如金刚石稳定
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
参考答案:B
本题解析:
试题分析:在相同的外界条件下,物质所含有的能量越低,该物质就越稳定。由于石墨在一定条件下可以转化为金刚石并需要吸收能量。所以等质量的金刚石的能量比石墨高,石墨比金刚石稳定。由于等质量的金刚石含有的能量比石墨高,当它们完全燃烧时所放出的热量金刚石就比石墨要多。即Q1<Q2。因为石墨和金刚石都是碳元素的单质,根据质量守恒定律可知,若二者的质量相等,则其完全燃烧,产生的二氧化碳一样多。因此错误的说法为B。
本题难度:一般
3、选择题 参照反应Br+H2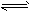 HBr+H的能量对反应历程的示意图,下列叙述中正确的是 HBr+H的能量对反应历程的示意图,下列叙述中正确的是
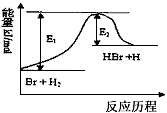 [???? ] [???? ]
A.该反应的△H=+(E1-E2)kJ/mol
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列变化属于吸热反应的是
①碳与二氧化碳化合
②生石灰与水反应生成熟石灰
③Zn与稀硫酸反应
④氯酸钾分解制氧气
⑤Ba(OH)2.8H2O与NH4Cl反应
⑥甲烷与氧气的燃烧
A.①④
B.②③
C.①④⑤
D.①②④
参考答案:C
本题解析:
试题分析:①是吸热反应,②是放热反应,③是放热反应,④是吸热反应,⑤是吸热反应,⑥是放热反应,答案选C。
本题难度:一般
5、选择题 向体积为2L且固定的密闭容器中充入2 molSO2和1 molO2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是
A.若使用高效催化剂,第一次达到平衡时放出热量大于176.4kJ
B.第一次反应达到平衡时,容器内压强为0.7p
C.达到新平衡时,该反应的平衡常数增大
D.若升高容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
参考答案:BD
本题解析:
试题分析:向体积为2L且固定的密闭容器中充入2 molSO2和1 molO2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此
本题难度:一般
|