微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
参考答案:(13分) (1) 2Fe2++H2O2+4NH3·H2O=
本题解析:
试题分析:(1)H2O2可以把Fe2+氧化为Fe3+,然后加入氨水,就会形成Fe(OH)3沉淀而过滤除去,反应的离子方程式是2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+;(2)pH=8.0,则c(OH—)=10-6mol/L,在通常条件下Ksp〔Fe(OH)3〕=c(Fe3+)·c3(OH—)=4.0×10—38,所以c(Fe3+)= Ksp〔Fe(OH)3〕÷c3(OH—)= 4.0×10—38÷10-18=4×10—20mol/L;(3)硫酸铝是强酸弱碱盐,水解产生氢氧化铝胶体和硫酸,加入硫酸就可以抑制盐电离产生的Al3+的水解;(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干是因为蒸干容易使晶体失去结晶水,这样还避免可溶性杂质结晶析出;(5)把晶体从混合物中“分离”操作的名称是过滤;(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L在铵明矾的水溶液中,根据物料守恒可知离子浓度最大的离子是SO42—,由于该盐是强酸弱碱盐,NH4+、Al3+水解消耗水电离产生的OH-,使溶液显酸性,所以离子浓度最小的离子是OH—。
考点:考查物质制取的知识,包括反应条件的选择、离子方程式的书写、溶度积常数的应用、盐的水解、离子浓度的大小比较的知识。
本题难度:困难
2、选择题 下列说法错误的是
A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则c(Na+)=c(CH3COO-)
B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-)
C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则pH>7
D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
参考答案:B
本题解析:
试题分析:根据电荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,故c(Na+)=c(CH3COO-),A正确;NaCl溶液呈中性,c(H+)= c(OH-),故B错误;2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后,得到等物质的量浓度的NaCN和HCN,根据电荷守恒,c(Na+)+ c(H+)= c(OH-)+c(CN-),c(Na+)>c(CN-),所以c(H+)<c(OH-),故C错误;NaHCO3和Na2CO3的混合液中,c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—),符合电荷守恒,故D正确。
考点:本题考查盐的水解、弱电解质电离。
本题难度:困难
3、填空题 (1)已知:25℃时,一些弱电解质的电离常数如下:NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离)。则:NH4HCO3溶液显 性 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积 (填“>”、“<”、“=”)氢氧化钠溶液体积。
(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,A溶液呈碱性的原因是(用离子方式程式表示)________________
(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: ;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释
(5)已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15。在AB2、AC均为饱和的混合液中,测得c(B—)=1.6×10—3 mol·L-1,则溶液中c(C2—)为 mol/L。
参考答案:(1)(1分)碱
(2)(1分)中性,(1分)>
本题解析:
试题分析:(1)NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离),这说明了碳酸氢根离子的水解程度比铵根离子更加弱,所以其水解程度较大,故NH4HCO3溶液显碱性;2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以得到:c(CH3COO-)+ c(OH-)=c(Na+)+ c(H+),因为c(CH3COO-)=c(Na+),所以 c(OH-)=c(H+),故混合后溶液呈中性,醋酸体积>氢氧化钠溶液体积;(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,说明了B离子发生了水解,其离子方程式为Bn-+H2O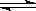 HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,
HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,
c(C2—)=Ksp(AC)/c(A2+)=3.0×10—15/1.64×10—2=1.83×10—13mol·L-1。
考点:盐类水解、电荷守恒、溶度积的计算
点评:本题考查了盐类水解,电荷守恒、溶度积的计算,这些知识是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:一般
4、选择题 下列水解离子方程式正确的是
A.Na2CO3∶CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B.NH4Cl∶NH4++H2O NH3·H2O+OH-
NH3·H2O+OH-
C.NaF∶F-+H2O===HF+OH-
D.CuSO4∶Cu2++2H2O  Cu(OH)2+2H+
Cu(OH)2+2H+
参考答案:D
本题解析:
试题分析:A.Na2CO3分步水解∶CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+2OH-;B.NH4Cl∶NH4++H2O
H2CO3+2OH-;B.NH4Cl∶NH4++H2O NH3·H2O+H+;C.NaF∶F-+H2O
NH3·H2O+H+;C.NaF∶F-+H2O HF+OH-;答案选D。
HF+OH-;答案选D。
考点:考查水解离子方程式的书写。
本题难度:一般
5、选择题 常温下,有下列四种溶液:
①
| ②
| ③
| ④
|
0.1mol/L
NaOH溶液
| pH=11
NaOH溶液
| 0.1mol/L
CH3COOH溶液
| pH=3
CH3COOH溶液
下列说法正确的是
A.由水电离出的c(H+):③<①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)> c(H+) > c(Na+)>c(OHˉ)
参考答案:D
本题解析:
试题分析:A项,NaOH完全电离,CH3COOH部分电离,前者对水的电离抑制程度大,故由水电离出的c(H++):①<③;B项,0.1mol·L-1CH3COOH溶液,稀释100倍,无法计算其pH值,错误;C项,①③若等体积混合,溶液呈碱性,若呈中性,则碱不足,即V(NaOH)<V(CH3COOH);D项c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ)是CH3COOH过量很多的情况,正确。
考点:酸碱对水的电离平衡的影响,酸碱的混合时的pH计算,盐的水解,溶液中离子浓度的比较。
本题难度:一般
|