微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
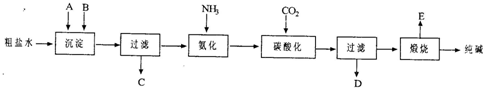
1、填空题 工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。 A_______,B_________。
(2)实验室提纯粗盐的实验操作依次为:取样、____ 、沉淀、____、____、冷却结晶、____ 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_____________。碳酸化时没有析出碳酸钠晶体,其原因是______________。
(4)碳酸化后过滤,滤液D最主要的成分是____(填写化学式),检验这一成分的阴离子的具体方法是:_____________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:______________________, 滤液D加石灰水前先要加热,原因是______________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:_________ (注明你的表达式中所用的有关符号的含义)。
2、简答题 工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):______.
3、填空题 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为____________________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_______________ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
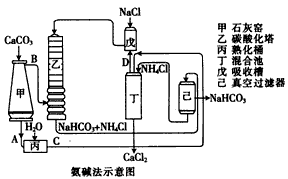
①图中的中间产物C是__________,D是________(写化学式);
②装置乙中发生反应的化学方程式为_____________________;
(3)联合制碱法是对氨碱法的改进,其优点是___________________;
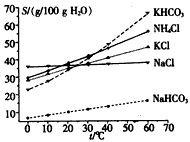
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?________________________
4、简答题 纯碱(Na2CO3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na2CO3的流程图.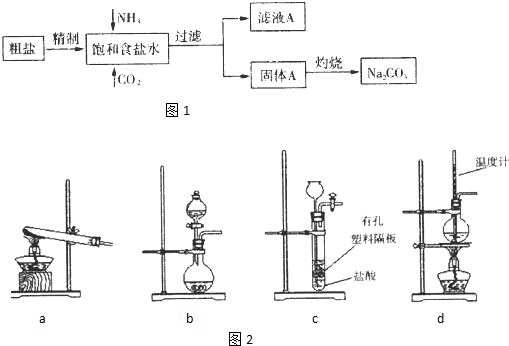
已知:向饱和食盐水中通入NH3、CO2后发生和反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等.
精制除杂的步骤顺序a→______→______→______→b(填字母编号).
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是______.
(2)灼烧固体A制Na2CO3在______(填字母序号)中进行.
a.坩埚b.蒸发皿c.烧杯d.锥形瓶
证明滤液A中含有NH4+的方法是______.
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3.使pH降低,反应的离子方程式______.
(3)图2装置中常用于实验室制备CO2的是______(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂______(填试剂名称).
(4)一种天然碱晶体成分是aNa2CO3?bNa2CO3?cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案.(仪器自选)请把实验方案填全:供选择的试剂:1mol?L-1H2SO4溶液、1.0mol?L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水.
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
5、选择题 “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是( )