微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)在由铜片、锌片和200 mL一定浓度的稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,请填空并计算:
①正极的电极反应式为???????????????;负极的电极反应式为???????????????;
②通过导线的电子的物质的量;
③求原稀硫酸的物质的量浓度。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、选择题 埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀速度最慢的是[???? ]
A.在含铁元素较多的酸性土壤中
B.在潮湿输送透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多,潮湿透气的土壤中
参考答案:C
本题解析:
本题难度:简单
3、填空题 锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为??????????。
(2)写出“正极碱浸”中发生反应的离子方程式?????????????????????。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式?????????????????????????????????????????????????????????;可用盐酸代替H2SO4和H2O2的混合液,但缺点是??????????????????????????。
(4)写出“沉钴”过程中发生反应的化学方程式??????????????????????。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式?????????????????????????????????????????????????????????。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是??????。在整个回收工艺中,可回收到的金属化合物有???????????????(填化学式)。
参考答案:
(1)+3
(2)2Al + 2OH- + 6
本题解析:以工艺流程为背景考查化学反应原理中的电化学知识,包括电极反应式的书写、氧化还原反应,综合性较强。
(1)根据化合价代数和为0的原则,LiCoO2中Li为+1价,O为-2价,iCo元素的化合价为+3。
(2)根据工艺流程和相关产物可知,锂离子电池正极材料中只有铝箔与氢氧化钠反应,发生反应的离子方程式2Al + 2OH- + 6H2O = 2Al(OH)- 4 + 3H2↑。
(3)根据“酸浸”的反应物和反应条件,发生的所有氧化还原反应的化学方程式为;2LiCoO2 + 3H2SO4 + H
本题难度:一般
4、填空题 某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是?????(填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是?????????????。
A.NiO2
B.Fe
C.Fe(OH)2
D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的??????极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。??????????????????????????????。
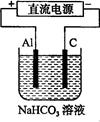
(4)精炼铜时,粗铜应与直流电源的??????极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
开始沉淀时的pH
| 2.3
| 7.5
| 5.6
| 6.2
|
完全沉淀时的pH
| 3.9
| 9.7
| 6.4
| 8.0
?
则加入H2O2的目的是??????????????????????????????????????????????????,乙同学认为应将方案中的pH调节到8,你认为此观点??????(填“正确”或“不正确”),理由是???????????????????????????。
参考答案:(1)C??? 0.4NA或2.408×1023(2)负
本题解析:
试题分析:(1)充电时Fe(OH)2得到电子,被还原,发生还原反应,变为Fe。内产生1mol的Fe(OH)2,转移电子2mol,现在产生Fe(OH)2的物质的量为18g÷90g/mol=0.2mol,所以转移电子的物质的量为0.4NA。(2)为防止轮船被腐蚀,应该把轮船的船体与外界电源的负极相连,这样轮船就不会失去电子,从而得到保护。(3)Al作阳极,发生反应:Al-3e-=Al3+;在溶液中发生反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑。因此可看到溶液变浑浊同时冒气泡。(4)精炼
本题难度:一般
5、选择题 如图是探究铁发生腐蚀的装置图。发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是
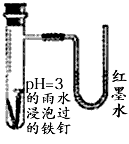
[ ??? ]
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应均为:
D.析氢腐蚀的总反应为: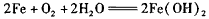
参考答案:D
本题解析:
本题难度:一般
|