微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列表示不正确的是
A.1mol H2
B.1molFe
C.1mol小米
D.1mol NH3
参考答案:C
本题解析:略
本题难度:简单
2、选择题 若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4 NA
③电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1 ?FeCl3溶液中含Fe3+数为2NA
⑦2 L1 mol·L-1的盐酸中所含氯化氢分子数为2NA
A.①④⑦
B.②⑥
C.③④⑤
D.②⑤
参考答案:D
本题解析:标准状况下,四氯化碳不是气体,不能适用于气体摩尔体积,①不正确;由于粗铜中含有杂质,所以最初失去电子的是活泼的就是锌、铁等,因此阴极得到电子数为2NA个,则阳极质量减少不是64 g,③不正确;CnH2n的最简式是CH2,所以7g中含有的氢原子是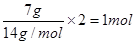 ,④不正确;⑥不正确,因为铁离子水解生成氢氧化铁,所以溶液中含有的铁
,④不正确;⑥不正确,因为铁离子水解生成氢氧化铁,所以溶液中含有的铁
本题难度:一般
3、计算题 (8分)把11.2 升(标准状况下)HCl气体溶于水,配制成250 mL的溶液,计算:(要求有过程)
(1)该溶液中HCl的物质的量浓度。
(2)若将该溶液与足量的锌反应,在标准状况下能生成氢气多少升?
参考答案: 2mol/L??? 5.6L
本题解析:略
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数,下列说法正确的是

A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.N60结构如右图,28gN60单质中含有的N-N键个数为NA
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失
去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
参考答案:C
本题解析:阿伏加德罗常数正误判断题在注重对有关计算关系考查的同时,又隐含对某些概念理解的考查。试题计算虽然难度不大,但概念性强,区分度大,是每年高考的必考试题。选项A中,由于HF分子中存在氢键,在标准状况下呈液态,因此1molHCl与HF的混合物的体积应小于22.4L。选项B中,N60分子中所含N-N键的数目为60×3/2=90,因此28gN60单质中含有的N-N键个数为28×90/(14×60)=3NA。选项C中生石膏转化为熟石膏的化学方程式为:2[CaSO4·2H2O] 本题难度:一般
本题难度:一般
5、计算题 已知Mg能在CO2气体中燃烧(CO2+2Mg  ?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
参考答案:(1)11.5 g(2) 10
本题解析:
试题分析:(1)Mg和CO2反应的化学方程式为:CO2 + 2Mg  ?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5"
?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5"
本题难度:一般