微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。
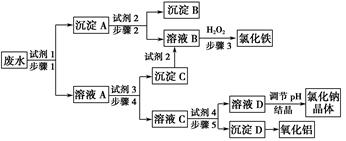
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为__________________________________。
(4)步骤3反应的离子方程式为__________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。
参考答案:(1)废铁屑 稀盐酸
(2)漏斗、玻璃棒、烧杯
本题解析:所加试剂的关键是有效地将Na+、Al3+、Fe3+、Cu2+、Cl-分离并得到相应产品。若试剂1为足量的废铁屑,Fe与Cu2+、Fe3+、H+反应经过滤后得到含有Fe、Cu的沉淀A,向Fe、Cu混合物中加入足量的稀盐酸得到Cu和FeCl2,FeCl2再与H2O2反应得到FeCl3:2Fe2++H2O2+2H+=2Fe3++2H2O。溶液A中含有Na+、Al3+、Fe2+、Cl-,利用Al(OH)3的两性实现Fe2+、Al3+的分离,所以试剂3为过量的NaOH溶液,沉淀C为Fe(OH)2,其与盐酸反应生成F
本题难度:一般
2、选择题 用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A.3:2:3
B.3:1:2
C.2:6:3
D.1:1:1
参考答案:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe
本题解析:
本题难度:一般
3、选择题 下列反应的离子方程式书写正确的是( )
A.向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液Ca2++HCO3-+OH-=CaCO3↓+H2O
B.金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑
C.用氢氧化钠溶液吸收二氧化碳2OH-+CO2=CO32-+H2O
D.Fe2(SO4)3的酸性溶液中通入足量硫化氢Fe3++H2S=Fe2++S↓+2H+
参考答案:A、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液,分别发生:HC
本题解析:
本题难度:一般
4、选择题 能正确解释下列反应原理的离子方程式( )
A.AlCl3溶液中通入过量的NH3:Al3++4NH3?H2O=AlO2-+4NH4+
B.淀粉碘化钾试纸上滴稀硝酸变蓝:2I-+4H++NO3-=I2+NO↑+2H2O
C.电解MgCl2饱和溶液:MgCl2
?电解?
.
?
Mg+Cl2↑
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-═CaCO3↓+SO42-
参考答案:A.因氨水不能溶解氢氧化铝,则AlCl3溶液中通入过量的NH
本题解析:
本题难度:简单
5、选择题 不能用离子方程式:CO32-+2H+═CO2↑+H2O来表示的反应是( )
A.K2CO3+H2SO4
B.Na2CO3+HCl
C.Na2CO3+HNO3
D.Na2CO3+CH3COOH
参考答案:K2CO3、Na2CO3都溶于水并完全电离成CO32-离子,
本题解析:
本题难度:简单
|