微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,向20 L的真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5)。反应完全后,容器内气体可能达到的最大密度是(?)
A.24.5 g/L
B.14.4 g/L
C.8 g/L
D.5.19 g/L
参考答案:B
本题解析:若容器内充入的全是H2S,则气体的最大密度是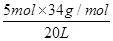 =8.5 g/L。若容器内充入的全是SO2,则气体的最大密度是
=8.5 g/L。若容器内充入的全是SO2,则气体的最大密度是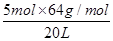 =16
=16
本题难度:一般
2、选择题 同体积、同物质的量浓度的BaCl2溶液可使同体积的Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42—完全沉淀,则三种硫酸盐中金属离子物质的量浓度之比为
A.1∶2∶3
B.2∶3∶6
C.1∶3∶6
D.6∶2∶1
参考答案:B
本题解析:
试题分析:设三种硫酸盐中金属离子物质的量浓度分别是a、b、c,则根据Ba2++SO42-=BaSO4↓可知,3a=b=c,解得a∶b∶c=2∶3∶6,答案选B。
点评:该题的关键是根据物质化学式找出该物质与所含SO42-的个数之比,然后带入关系式计算即可。
本题难度:一般
3、选择题 在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为(??? )
A.0.15mol/L
B.0.45mol/L
C.0.6mol/L
D.0.3mol/L
参考答案:D
本题解析:
物质的量浓度的相关计算.
分析:根据溶液不显电性,利用电荷守恒即可计算混合溶液中Na+的浓度.
解:因Na2SO4和Al2(SO4)3的混合溶液不显电性,
Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,设混合溶液中Na+的浓度为x,
根据电荷守恒可知,
0.1mol/L×3+x×1=0.3mol/L×2,
解得x=0.3mol/L,
故选D.
本题难度:简单
4、选择题 在标准状况下,如果11. 2L氧气含有n个氧原子,则阿伏加德罗常数可表示为
2L氧气含有n个氧原子,则阿伏加德罗常数可表示为
A.n
B.
C.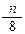
D.4n
参考答案:A
本题解析:略
本题难度:一般
5、填空题 (1)1molN含有________mol质子
(2)1.7gH2O2含有的原子数为________NA
(3)1molNa+含有________mol电子
(4)2.4g金属镁变成Mg2+失去电子数为________个
(5)用NA代表阿伏加德罗常数的值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是________L
(6)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
a.该气体溶于1L水中(不考虑反应),其溶液中溶质 的质量分数为_______。
b.该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ mol·L-1。
参考答案:(1)7
(2)0.2
(3)10
本题解析:
本题难度:一般