微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应C(固)+H 2O(气) CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(???? )
CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(???? )
A.增加C的量
B.将容器的体积缩小一半
C.升温
D.保持压强不变,充入N2使容器体积变大
2、填空题 (I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 大理石规格
| HNO3浓度/mol·L-1
| 实验目的
|
①
| 298
| 粗颗粒
| 2.00
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和__探究温度对该反应速率的影响;
(Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。
|
②
| ?
| ?
| ?
|
③
| ?
| 粗颗粒
| ?
|
④
| ?
| ?
| ?
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答: 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
| n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
(1)NO的平衡浓度c(NO)=??????????????;
(2)用O2表示从0~2s内该反应的平均反应速率为?????????????;
(3)右图中表示NO2变化的曲线是?????????;
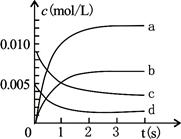
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V?????????????????????②体积不变充入He气体 V??????????????????
3、选择题 有关碰撞理论,下列说法中不正确的是
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
4、填空题 某研究性学习小组探究如下实验:在常温下,取两片质量相等、外形和组成相同且表面经过砂纸打磨完全去掉氧化膜的铝片,分别加入盛有相同体积、H+浓度相同的稀硫酸和稀盐酸的两支大小相同的试管中,发现铝片在稀盐酸中产生氢气的反应速率比在稀硫酸中的快。查阅相关资料后得知:化学反应速率主要由参加反应的物质的性质决定,其次是外界因素的影响。
(1)写出以上反应的离子方程式_______________________________。
(2)出现上述现象的原因可能:假设①SO42—对铝与H+的反应有抑制作用;假设②______________________________________。
(3)请设计实验对上述假设进行验证:
①____________________________________________;
②____________________________________________。
(4)如果上述假设都成立,要使上述稀硫酸与铝反应产生氢气的速率加快,可以采取的措施有:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
5、选择题 大气中的臭氧层可滤除大量的紫外光,保护地球上的生物.氟利昂可在光的作用下分解产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用.在上述反应中,Cl是( )
A.反应物
B.生成物
C.中间产物
D.催化剂
|
|