微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某一化学反应中,反应物A的浓度在20 s内从1.0 mol/L变为0.2 mol/L,则在这20 s内以A浓度的变化表示的平均反应速率为(???)
A.0.04 mol / (L·s)
B.0.04 mol / L
C.0.08 mol / (L·s)
D.0.08 mol / L
参考答案:A
本题解析:
试题分析:反应速率通常用单位时间内浓度的变化量来表示,则以A浓度的变化表示的平均反应速率为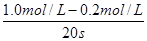 =0.04 mol / (L·s),答案选A。
=0.04 mol / (L·s),答案选A。
点评:该题是高考中的常见考点,属于常识性知识的考查。该题的关键是明确反应速率的含义以及计算依据,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
2、填空题 (17分)氢气和氨气都属于无碳清洁能。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s) △H<0(M表示某种合金)
MH2x(s) △H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________

a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。

①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g)  2NH3(g) △H=
2NH3(g) △H=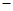 92.4kJ·mol-1
92.4kJ·mol-1
2H2(g)十O2(g)=2H2O(1) △H=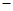 572KJ·mo1-1
572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)十3H2(g)  2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为 。
。
①该反应的平衡常数K=________,(用含 的代数式表示)
的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含 的代数式表示)
的代数式表示)
参考答案:本题共17分
(1)b(2分)
(2)①O2+4
本题解析:
试题分析:(1)a、温度升高,平衡逆向移动,则吸氢量减少,所以T1<T2,错误;b、增大氢气压强,则增大反应速率,加快氢气的吸收速率,正确;c、M是固体,所以增大M的量,上述平衡不移动,错误;d、在恒温、恒容容器中,达平衡后充入H2,压强增大,平衡正向移动,再次平衡后的压强减小,错误,答案选b;
(2)①甲为原电池,则乙为电解池,反应中b极质量增加,说明b极是阴极,有Cu析出,所以c是原电池负极,d是原电池正极,a是电解池阳极;d极为氧气、二氧化碳发生还原反应,得到电子生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;
②若用该装置电解精炼铜,则粗铜做阳极,精铜作阴极,b极是阴极,所以b极是精铜;若用该装置给铁制品上镀铜,则铜作阳极,铁作阴极,所以b极一定是铁制品,则a极可用惰性电极;因为铜离子放电析出,需经常补充或更换的是CuSO4溶液;
(3)根据盖斯定律,将所给两个热化学方程式中的氢气消去,可得氨气与氧气反应的热化学方程式,得4NH3(g)+ 3O2(g)=2N2(g)+6H2O(l) △H=-1531.2kJ·mol-1;
(4)① N2(g)十3H2(g)  2NH3(g)
2NH3(g)
开始(mol/L) 0.1 0.3
转化(mol/L) 0.1 0.3
0.3 0.2
0.2
平衡(mol/L)0.1(1- ) 0.3(1-
) 0.3(1- ) 0.2
) 0.2
所以该反应的平衡常数K=(0.2 )2/[0.1(1-
)2/[0.1(1- )] ·[ 0.3(1-
)] ·[ 0.3(1- )]3=400α2/27(1-α)4;
)]3=400α2/27(1-α)4;
②从反应开始到平衡时N2的消耗速率v(N2)=0.1 /5min=0.02α.
/5min=0.02α.
考点:考查条件对平衡的影响,平衡常数、反应速率的计算,电化学反应原理的应用,
本题难度:困难
3、选择题 改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.降低温度
B.增大压强
C.使用催化剂
D.增大反应物浓度
参考答案:加入催化剂可提高反应物中的活化分子百分数;降低温度降低反应物
本题解析:
本题难度:简单
4、选择题 某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.005
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
参考答案:BC
本题解析:
试题分析:A、碳是固体,不能用来表示反应速率,A不正确;B、5 min达到平衡后,密度增加了0.3 g/L,则容器中气体的质量增加了0.6g,则根据方程式C(s)+H2O(g) CO(g)+H2(g)可知增加的质量就是参加反应的碳的质量,物质的量是0.6g÷12g/mol=0.05mol,则
CO(g)+H2(g)可知增加的质量就是参加反应的碳的质量,物质的量是0.6g÷12g/mol=0.05mol,则
C(
本题难度:一般
5、选择题 下列关于化学反应速率的说法错误的是[???? ]
A.化学反应速率是用于衡量化学反应进行快慢的物理量
B.决定化学反应速率的主要因素是反应物本身的性质
C.可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
D.增大反应物浓度或升高反应温度都能加快化学反应速率
参考答案:C
本题解析:
本题难度:一般