微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 物质结构理论指出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是(??)。
A.镁的硬度小于铝
B.镁的熔、沸点低于钙
C.镁的硬度大于钾
D.钙的熔、沸点高于钾
参考答案:B
本题解析:本题为信息给予题,主要考查自学能力、思维能力和原子结构知识。根据题目所给予信息:镁和铝的电子层数相同,价电子数:Al>Mg,离子半径:Al3+<Mg2+,Al的硬度大于镁;镁、钙价电子数相同,但离子半径:Ca2+>Mg2+,金属键强弱:Mg>Ca,所以B不正确;用以上比较方法可推出:离子半径:Mg2+<Na+<K+,所以金属键:Mg>K,硬度:Mg>K,所以C正确;钙和钾元素位于同一周期,价电子数:Ca>K,离子半径:K+>Ca2+,金属键:Ca>K,熔点:Ca>K,所以D正确。
本题难度:一般
2、选择题 2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/ mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是
mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是
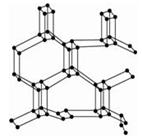
A.高聚氮晶体属于分子晶体
B.高聚氮晶体中每个N原子和另外3个N原子相连
C.高聚氮转变成氮气是氧化还原反应
D.高聚氮可能成为炸药
参考答案:AC
本题解析:略
本题难度:一般
3、选择题 形成物质世界多样性的原因有:(????? )
①元素种类?②同位素?③化学键成键方式?④同分异构现象?⑤同素异形现象
A.仅①②③
B.仅②④⑤
C.仅①③
D.①②③④⑤
参考答案:D
本题解析:
试题分析:物质都是由元素组成的,而元素大部分都有同位素。元素在形成物质,化学键的成键方式不同,同一元素可以形成不同的单质,大部分物质都是由有机物组成的,而有机物大部分都存在同分异构现象,这些均是形成物质世界多样性的原因,答案选D。
点评:该题是基础性试题的考查,难度不大,注意相关知识的积累和总结。
本题难度:一般
4、填空题 【二选一—物质结构与性质】
碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。
(1)基态铜原子的价电子排布式为___________,铜原子的电子占有___________种能量不同的原子轨道。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为___________杂化。
(3)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是________________?。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:
表中的金属元素是_____________(填字母)。若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______________。 ?
(5)元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________?;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_______________。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为____________。
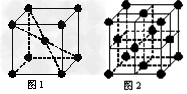
参考答案:(1)[Ar]?3d104s1;????7
(2)sp
本题解析:
本题难度:一般
5、选择题 下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为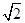 ·
·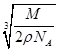 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
参考答案:D
本题解析:A项,键长:C—C<C—Si<Si—Si,键的强度C—C>C—Si>Si—Si,故熔点按金刚石、碳化硅、晶体硅的顺序依次降低,正确; B项,由一个NaCl晶胞中含有4个Na+和4个Cl-可知,每个CaO晶胞中含有4个Ca2+和4个O2-;C项,设Na+和Cl-的最近距离为a cm,则两个最近的Cl-间的距离为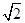 本题难度:一般
本题难度:一般