微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445KJ的热量,则下列热化学方程式中正确的是[???? ]
A、2CH4(g)+4O2(g)==?2CO2(g)+4H2O(l);?ΔH=+890kJ/mol??
B、CH4(g)+2O2(g)==?CO2(g)+2H2O(l);?ΔH=+890kJ/mol??
C、CH4(g)+2O2(g)==?CO2(g)+2H2O(l);?ΔH=–890kJ/mol??
D、1/2CH4(g)+?O2(g)==?1/2CO2(g)+?H2O(l);?ΔH=–890kJ/mol?
参考答案:C
本题解析:
本题难度:简单
2、选择题 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( ? )
A.C+H2O═CO+H2△H=+131.28kJ?mol-1
B.C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94?kJ?mol-1
C.C(s)+H2O(l)═CO(g)+H2(g)△H=+131.28kJ?mol-1
D.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ?mol-1
参考答案:D
本题解析:
本题难度:简单
3、填空题 (10分)一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: ,则该反应的△ H 0(选填“>”或“<”)。
,则该反应的△ H 0(选填“>”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
(4)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
参考答案:(1)< (2)2CO(g
本题解析:
试题解析:(1)反应Ni(s)+4CO(g) Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3="-270" kJ?mol-1;(3)设5min末消耗COamol/L,则:CO(g)+H2O(g)
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3="-270" kJ?mol-1;(3)设5min末消耗COamol/L,则:CO(g)+H2O(g) CO2(g)+H2(g),
CO2(g)+H2(g),
初始量(mol/L): 3 3 0 0
变化量(mol/L): a a a a
5min末(mol/L): 3-a 3-a a a
K=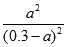 =9.0,解得a=2.2.5mol/L,故CO的转化率=
=9.0,解得a=2.2.5mol/L,故CO的转化率= ×100%=75%;(4)①CO具有还原性在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-
×100%=75%;(4)①CO具有还原性在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-
本题难度:困难
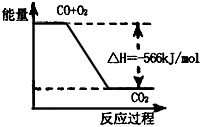
4、选择题 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2 (g) △H=-226lkJ·mol-1,
根据以上热化学方程式判断,下列说法正确的是
 [???? ]
[???? ]
A.CO的燃烧热为283kJ
B.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ·mol-1
C.上图可表示由CO生成CO2的反应过程和能量关系
D.CO(g)与Na2O2反应放出509kJ热量时,电子转移数为6.02×1023
参考答案:B
本题解析:
本题难度:一般
5、填空题 (1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
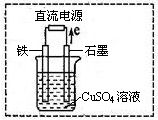
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。

参考答案:(1)2C2H6(g)+7O2(g)=4CO2(g)+6H2
本题解析:
 试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
故答案为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;
(2)利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-; ①-②×7 得到负极电极反应为:C2H6-14e-+18OH-
本题难度:困难