微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2
与H2反应生成NH3的热化学方程式为______________.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) △H=- 870.3 kJ·mol-1
②C(s)+O2(g) = CO2(g) △H=-393.5 kJ·mol-1
③H2(g)+O2(g) = H2O(l) △H=-285.8 kJ·mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) = CH3COOH(l) △H= __________。
参考答案:(1)N2(g)+3H2(g)![]() 本题解析:
本题解析:
本题难度:一般
2、填空题 (10分).工业合成氨与制备硝酸一般可连续生产,流程如图所示:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
T/℃
| T1
| 300
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。
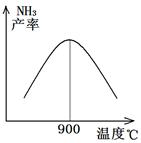
温度高于900℃时,NH3产率下降的原因是 。
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
参考答案:(1)1(2分); (2)< (2分)(3)
本题解析:
试题分析: (1)CO + H2O(g) CO2 + H2 CO2 + H2
C开始(mol/L) 0.2 0.3 0 0
C改变(mol/L)0.12 0.12 0.12 0.12
C平衡(mol/L)0.08 0.18 0.12 0.12
所以平衡常数K=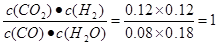 ; ;
(2)由于反应N2(g)+3H2(g) 2NH3(g)的正反应是放热反应,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,即对该反应来说,平衡向逆反应方向移动,所以化学平衡常数减小,由于在温度是T1时的平衡常数1.00×107大于300℃时的平衡常数2.45×105,所以T1<300℃; 2NH3(g)的正反应是放热反应,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,即对该反应来说,平衡向逆反应方向移动,所以化学平衡常数减小,由于在温度是T1时的平衡常数1.00×107大于300℃时的平衡常数2.45×105,所以T1<300℃;
(3)N2和H2以铁作催化剂从145℃就开始反应,在不同温度下NH3的产率如图所示,在温度高于900℃时,NH3产率下降的原因是温度高于>900℃时,升高温度,平衡向左移动,所以NH3的平衡含量减小,因此产率降低;
(4)(①+②)÷2,整理可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g); ΔH=-867KJ/mol;
(5)在氨气-氧气燃料电池中,通入氨气的电极是负极,则碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+ 6H2O。
考点:考查化学平衡常数的计算、温度对化学平衡移动的影响、热化学方程式及原电池电极式的书写。
本题难度:困难
3、填空题 (15分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出肼和过氧化氢的结构式。肼__________________,过氧化氢______________ 。
(2)写出热化学方程式_________________________________________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_____________________ kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是________________________________________________________。
参考答案:(2)N2H4(1)+2H2O2(1)==N2(g)+4H2
本题解析:略
本题难度:一般
4、填空题 (1)1.00L?1.00mol/L硫酸溶液与2.00L?1.00mol/L?NaOH溶液完全反应,放出114.6kJ的热量,写出该反应的热化学方程式______;由此得出,强酸与强碱在稀溶液中反应的中和热△H=______.
(2)H2O(l)═H2O(g)△H=+44kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol
则H2的燃烧热△H=______
(3)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放______kJ的能量.
参考答案:(1)1.00L?1.00mol/L硫酸的物质的量为1mol
本题解析:
本题难度:一般
5、选择题 根据以下三个热化学方程式:
2H2S(g)+3O2(g) → 2SO2(g)+2H2O(1)+akJ
2H2S(g)+O2(g) → 2S(s)+2H2O(1)+bkJ
2H2S(g)+O2(g) → 2S(s)+2H2O(g)+ckJ(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
A.a>b>c
B.a>c>b
C.c>b>a
D.b>a>c
参考答案:A
本题解析:硫化氢完燃烧放出的能量高,所以a>b。气态水的能量高于液态水的,所以硫化氢燃烧生产液态水放出的能量多,因此b>c,答案选A。
本题难度:一般
91ExAM.org
|