干燥的有色布条
?
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E。观察到的现象是????????????????? ??????????。该现象??????(填“能”或“不能”)说明溴的非金属性强于碘,原因是?????????????????????????????????????。
参考答案:(1)2MnO4- + 16H++10Cl-= 2 Mn2+
本题解析:
试题分析:
(1)K+一定不参与反应,故,省略。Mn从+7价到+2价,得到5个电子,生成Cl2,2Cl-失去2个电子,2,5为互质数,故,Cl2乘五Mn乘二。
(2)所除的杂质为HCl,所谓安全瓶是防止气体冲开瓶塞的。
(3)经观察,中间都是除水的(固态,排除B)物质,故开头为含水的湿布条。
(4)苯比水轻,故在上层(事实上,所有的烴比水轻)。不能,Cl2不一定被除干净。
本题难度:一般
2、选择题 用玻棒蘸取新制氯水滴在PH试纸中部,观察到的现象是( )
A.

B.

C.
D.

参考答案:根据氯水的成分:含有氯气和次氯酸以及盐酸等成分,具有酸性,其
本题解析:
本题难度:简单
3、选择题 高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是???????????????????????????????????????????????????????????
A.1∶2
B.5∶4
C.4∶7
D.7∶4
参考答案:C
本题解析:
4NH4ClO4 2N2↑+4HCl+5O2↑+6H2O 2N2↑+4HCl+5O2↑+6H2O
还原产物为HCl
氧化产物为N2,O2,
比值为4∶(5+2)=4∶7。
本题难度:一般
4、选择题 下列说法正确的是( )
A.漂白粉的有效成分是氯化钙和次氯酸钙
B.欲除去氯气中少量的氯化氢气体,可将此混合气体通过盛饱和氢氧化钠溶液的洗气瓶
C.将氯水滴入碳酸钠溶液中,无明显现象出现
D.向久置的氯水中滴入紫色石蕊试液,溶液将变红
参考答案:D
本题解析:
试题分析:漂白粉的主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,A不正确;B不正确,因为氯气也能和氢氧化钠溶液反应,应该用饱和食盐水;氯气中含有盐酸,能和碳酸钠溶液反应,C不正确;次氯酸不稳定,易分解生成氯化氢和氧气,则氯水久置后将变为稀盐酸,滴入紫色石蕊试液,溶液将变红色,D正确,答案选D。
点评:该题紧扣教材,基础性强,侧重对学生基础知识的检验和训练,难度不大。该题的关键是熟练记住氯水的主要成分以及性质特点,然后结合题意灵活运用即可。
本题难度:一般
5、选择题 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示。
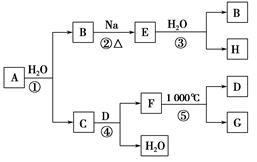
下列说法正确的是???????????????????? ( )。
A.反应①、③中H2O均是还原剂
B.工业上常用C的悬浊液与Cl2反应制取漂白粉
C.D与H溶液反应后所得溶液的溶质成分有三种可能
D.电解F与盐酸反应后的溶液以制取单质A
参考答案:B
本题解析:ⅡA族元素有Be、Mg、Ca等,由在自然界中广泛存在可知是Ca,则B为H2,E为NaH,H为NaOH,C为Ca(OH)2,由F在1000 ℃分解且是钙常见化合物,可知F为CaCO3。在反应①、③中均有H2生成,H2O均作氧化剂,A错误;工业上制漂白粉是用Ca(OH)2悬浊液和Cl2反应制得,B项正确;NaOH与CO2反应溶液的组成可能为:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种可能,C错误;钙是活泼金属不能通过电解溶液获得,D错误。
本题难度:一般
|